Pulsar – Chemie vwo bovenbouw deel 2 Uitwerkingen Hoofdstuk 9
■■
9
Zuren en basen
■■
9.1 Indicatoren en pH
Vragen bij de proef
1 Het omslagtraject van broomthymolblauw ligt
tussen pH = ±6 en pH = ±8.
2 Vergelijk je uitkomsten met de getallen in tabel
52A van Binas.
1 NB: de waarden van de pH kunnen verschillen met
de waarden die jullie gemeten hebben.
oplossing
azijn
sodaoplossing
zoutzuur
pekelwater
loog
accuvloeistof
ammonia
kraanwater
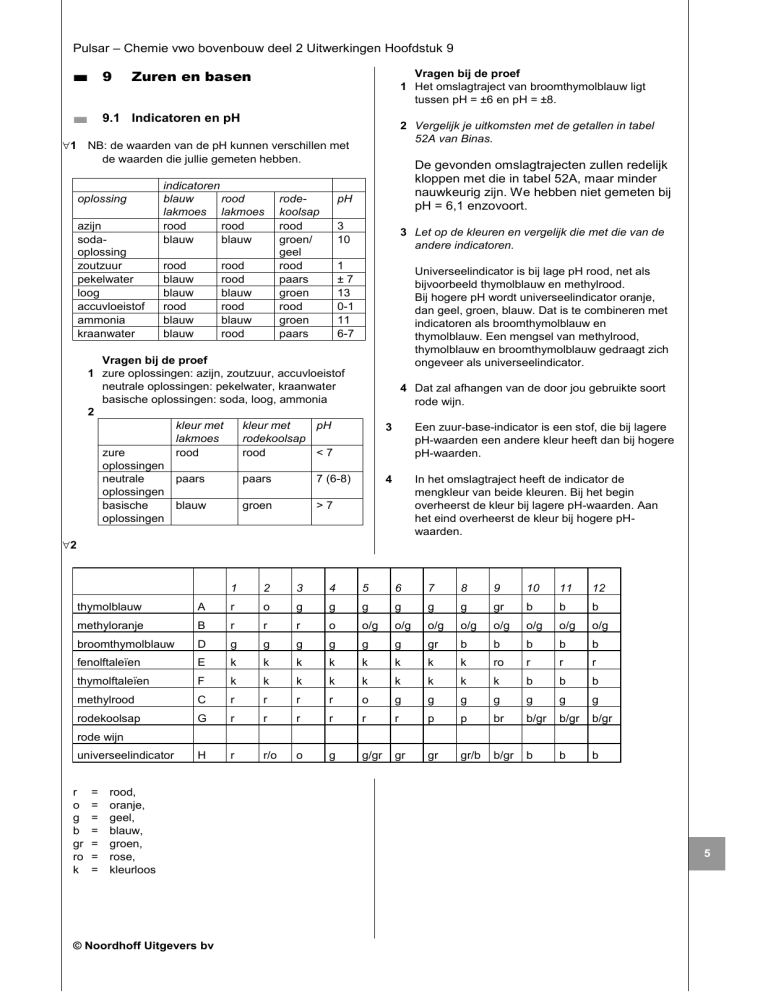
indicatoren
blauw
rood
lakmoes lakmoes
rood
rood
blauw
blauw
rood
blauw
blauw
rood
blauw
blauw
rood
rood
blauw
rood
blauw
rood
rodekoolsap
rood
groen/
geel
rood
paars
groen
rood
groen
paars
De gevonden omslagtrajecten zullen redelijk
kloppen met die in tabel 52A, maar minder
nauwkeurig zijn. We hebben niet gemeten bij
pH = 6,1 enzovoort.
pH
3
10
3 Let op de kleuren en vergelijk die met die van de
andere indicatoren.
1
±7
13
0-1
11
6-7
Universeelindicator is bij lage pH rood, net als
bijvoorbeeld thymolblauw en methylrood.
Bij hogere pH wordt universeelindicator oranje,
dan geel, groen, blauw. Dat is te combineren met
indicatoren als broomthymolblauw en
thymolblauw. Een mengsel van methylrood,
thymolblauw en broomthymolblauw gedraagt zich
ongeveer als universeelindicator.
Vragen bij de proef
1 zure oplossingen: azijn, zoutzuur, accuvloeistof
neutrale oplossingen: pekelwater, kraanwater
basische oplossingen: soda, loog, ammonia
2
kleur met
kleur met
pH
lakmoes
rodekoolsap
zure
rood
rood
<7
oplossingen
neutrale
paars
paars
7 (6-8)
oplossingen
basische
blauw
groen
>7
oplossingen
4 Dat zal afhangen van de door jou gebruikte soort
rode wijn.
3
Een zuur-base-indicator is een stof, die bij lagere
pH-waarden een andere kleur heeft dan bij hogere
pH-waarden.
4
In het omslagtraject heeft de indicator de
mengkleur van beide kleuren. Bij het begin
overheerst de kleur bij lagere pH-waarden. Aan
het eind overheerst de kleur bij hogere pHwaarden.
2
1
2
3
4
5
6
7
8
9
10
11
12
thymolblauw
A
r
o
g
g
g
g
g
g
gr
b
b
b
methyloranje
B
r
r
r
o
o/g
o/g
o/g
o/g
o/g
o/g
o/g
o/g
broomthymolblauw
D
g
g
g
g
g
g
gr
b
b
b
b
b
fenolftaleïen
E
k
k
k
k
k
k
k
k
ro
r
r
r
thymolftaleïen
F
k
k
k
k
k
k
k
k
k
b
b
b
methylrood
C
r
r
r
r
o
g
g
g
g
g
g
g
rodekoolsap
G
r
r
r
r
r
r
p
p
br
b/gr
b/gr
b/gr
H
r
r/o
o
g
g/gr
gr
gr
gr/b
b/gr
b
b
b
rode wijn
universeelindicator
r
o
g
b
gr
ro
k
=
=
=
=
=
=
=
rood,
oranje,
geel,
blauw,
groen,
rose,
kleurloos
© Noordhoff Uitgevers bv
5
Pulsar – Chemie vwo bovenbouw deel 2 Uitwerkingen Hoofdstuk 9
5
Een pH-meter is nauwkeuriger dan
universeelindicator.
6
–
7
■■
9.2 Zuren en zure oplossingen
13
oplossing
van
pH
HCl
NaCl
HNO3
NaNO3
CH3COOH
CH3COONa
1
7
1
7
3
9
Vragen bij de proef
1 De pH van 0,01 M zoutzuur is (ongeveer) 2.
2 Je zult ongeveer 90 mL zoutzuur moeten
toevoegen.
3 Dit zul je zelf moeten bepalen.
8
–
9 a Tijdens het koken van peren komen zuren vrij,
waardoor de pH daalt. Daardoor verandert de
kleur van een aantal kleurstoffen in de peertjes.
14
10
methylrood
broomthymol
blauw
lakmoes
fenolftaleïen
thymolblauw
12
15
12
geel
blauw
rood
kleurloos
oranje
blauw
paarsrood
blauw
paars
kleurloos
geel
Kijk nog eens goed naar het antwoord op
opdracht 13.
Een waterstofatoom bestaat uit een proton (de
kern) en een elektron. Een waterstofion H+ heeft
een elektron minder en is dus een proton.
b Zie ook hoofdstuk 1.
Het elektron bevindt zich op relatief grote afstand
van de kern. Die afstand bepaalt de grootte van
het atoom. De ruimte tussen de kern en het
elektron is leeg. Als het elektron verdwijnt, blijft er
dus een H+ ion, een proton over. De afmetingen
van een proton zijn veel kleiner dan die van een
waterstofatoom.
Zoek twee indicatoren in Binas op.
Op grond van de eerste indicator kun je
concluderen: de pH is groter dan ...
Op grond van de tweede indicator kun je
concluderen: de pH is lager dan ...
17
Ludo kan gebruik gemaakt hebben van
broomthymolblauw en van thymolblauw. Met
broomthymolblauw is de kleur blauw; de conclusie
is dan: de pH is groter dan 7,6.
Met thymolblauw is de kleur geel; de conclusie is
dan: de pH is lager dan 8,0.
Dit levert samen de conclusie op dat de pH tussen
7,6 en 8,0 ligt.
6
Welke reactie verloopt wel met de drie zure
oplossingen en niet met de andere oplossingen?
16a Ga na hoe een waterstofatoom is opgebouwd.
oplossingen met pH van
2
5
7
rood
oranje
geel
geel
geel
groen
rood
kleurloos
geel
ja
nee
ja
nee
ja
nee
Overeenkomst: alle oplossingen geleiden stroom.
verschil 1: de zure oplossingen hebben een lage
pH (1 à 3). De andere oplossingen hebben een
pH 7 of hoger.
verschil 2: de zure oplossingen reageren met
magnesium, de andere oplossingen niet.
verschil 3: de zure oplossingen kleuren lakmoes
rood. De andere oplossingen doen dat niet.
Met afwaswater krijgen de restjes rode kool een
groene kleur. Volgens de proeven 1 en 2 wordt
rodekoolsap groen in een basische oplossing.
11
indicator
ontstaat een
gas met
magnesium?
De drie zure oplossingen reageren met
magnesium. Daarbij ontstaat waterstof. De zure
oplossingen moeten dus een deeltje bevatten,
waardoor het ontstaan van waterstof mogelijk is.
b Dat klopt: in zuur milieu heeft rode wijn een rode
kleur.
c In je werkplan moeten de volgende punten aan de
orde komen:
– meting van de pH van ongekookte peren.
– meting van de pH van gekookte peren.
– een maatregel om geen last te hebben van de
kleur van de peren. De peren kunnen mooi rood
worden en dat kan storen bij de metingen.
geleidt neerslag
stroom? met opl.
van zilvernitraat?
ja
ja
ja
ja
ja
nee
ja
nee
ja
nee
ja
nee
Het zuur reageert met water. Daarbij ontstaat een
zure oplossing, die oxoniumionen en zuurrestionen bevat.
a HBr(g) + H2O(l) H3O+(aq) + Br–(aq)
b HNO3(l) + H2O(l) H3O+(aq) + NO3–(aq)
c Een molecuul zwavelzuur kan twee H+ ionen
afstaan. Er zijn dan ook twee watermoleculen
nodig om beide H+ ionen te binden. Er ontstaan
per molecuul zwavelzuur twee oxoniumionen.
H2SO4(l) + 2 H2O(l) 2 H3O+(aq) + SO42–(aq)
© Noordhoff Uitgevers bv
Pulsar – Chemie vwo bovenbouw deel 2 Uitwerkingen Hoofdstuk 9
18
Ga na wat het verschil is tussen een
geconcentreerde oplossing en een verdunde
oplossing.
Als je een beetje water bij zwavelzuur doet, krijg je
geconcentreerd zwavelzuur. Voeg je veel meer
water toe dan krijg je verdund zwavelzuur.
Let op: in praktijk moet je het bij zwavelzuur
andersom doen; dus zwavelzuur toevoegen aan
water. Het gaat anders spatten.
19
c Het zuur wordt door de enorme hoeveelheid
rivierwater sterk verdund, waardoor de schadelijke
effecten grotendeels verdwijnen.
■■
9.3 Basen en basische oplossingen
23
Bedenk welk deeltje door een base wordt
opgenomen. Zie ook bron 8.
Een base is een deeltje dat een (positief) H+ ion
kan opnemen. Vooral negatieve ionen en
dipoolmoleculen (met hun – kant) zullen H+ ionen
aantrekken.
Wat is de juiste notatie voor de oplossing van een
zout? Wat is de juiste notatie voor de oplossing
van een zuur?
a Kaliumbromide is een zout; het is een vaste stof:
KBr(s).
24
b De oplossing moet in vrije ionen genoteerd
worden: K+(aq) + Br –(aq).
1 Door een zout op te lossen, waarvan het
negatieve ion OH– is.
2 Door een stof op te lossen die deeltjes bevat die
een H+ ion van een watermolecuul opnemen.
Bijvoorbeeld ammoniak, NH3, of natriumcarbonaat.
c In tabel 66A van Binas staat dat zoutzuur een
oplossing van waterstofchloride in water is.
Als HCl in water oplost, reageert het ook met
water. De moleculen HCl staan hun H+ ion af aan
watermoleculen. De notatie van de oplossing is
dan: H3O+(aq) + Cl–(aq).
Zie bron 9. Er zijn twee manieren om een
oplossing te krijgen die OH– ionen bevat.
25
Er zijn enkele oxides die met water reageren.
Daarbij ontstaat een basische oplossing. Zie bron
10. Wat is natronloog?
Natronloog is een oplossing die natriumionen en
hydroxide-ionen bevat. Je kunt die oplossing op
twee manieren maken:
1 Door natriumhydroxide op te lossen in water:
d Zie ook opdracht 17b.
Verdund salpeterzuuroplossing noteer je dus als
H3O+(aq) + NO3– (aq).
Na+(aq) + OH–(aq)
NaOH(s)
2 Door natriumoxide met water te laten reageren:
Na2O(s) + H2O(l) 2 Na+(aq) + 2 OH–(aq)
water
e Er is geen water aanwezig, dus geen oplossing.
Vaste fosforzuur is H3PO4(s).
20
Wat betekent ‘zuiver’ in de scheikunde?
26
Zuiver betekent: één stof. Zoutzuur is niet één stof,
maar een oplossing van waterstofchloride in water.
21
We nemen aan dat natriumhydroxide gewoon
oplost in water, net als keukenzout. Zie
vergelijking 1 in het antwoord op opdracht 25.
Het OH– ion is een base en zal een H+ kunnen
opnemen van een watermolecuul. Dit kun je als
volgt weergeven: OH– + H2O H2O + OH–
Je ziet dat er niets verandert! Het is dus een
academische vraag of dit ook gebeurt.
Zout: iets kan zout smaken: drop, zeewater.
Een zout is een stof, opgebouwd uit positieve en
negatieve ionen.
Zuur: iets kan zuur smaken: rabarber, zuurkool.
Een zuur is een stof die H+ ionen kan afstaan.
22a Een schip moet stoffen zo efficiënt mogelijk
vervoeren.
Een schip dat verdund salpeterzuur vervoert, heeft
vooral water aan boord. Om zo efficiënt mogelijk te
werken zal het een geconcentreerde oplossing
vervoeren.
b Welke dichtheid heeft 14 M salpeterzuur?
(Zie Binas tabel 43A)
De dichtheid van 14,29 M salpeterzuur is 1,385 kg
L–1. De dichtheid van 14 M salpeterzuur zal dan
ongeveer 1,3 kg L–1 zijn.
1800 ton salpeterzuur is 1,8 x 106 kg
1,8 x 106 kg is dan 1,8 x 106 : 1,3 = 1,4 x 106 L.
© Noordhoff Uitgevers bv
Wat ontstaat er als een hydroxide-ion met een
watermolecuul reageert?
27
Bariumoxide bevat een base. Welk deeltje van
bariumoxide is dat?
a Het oxide-ion is de base.
b Als het oxide-ion van een watermolecuul een H+
opneemt, ontstaat een OH– ion. Van het watermolecuul, dat het H+ ion heeft afgestaan, blijft dan
ook een OH– ion over.
BaO(s) + H2O(l) Ba2+(aq) + 2 OH–(aq)
c Kijk eens in tabel 45A van Binas.
Koperoxide is in water slecht oplosbaar.
7
Pulsar – Chemie vwo bovenbouw deel 2 Uitwerkingen Hoofdstuk 9
28a In ‘parate kennis’ op bladzijde 205 van deel 1 kun
je dat nazoeken.
■■
9.4 De pH van zure oplossingen
32
Bereken steeds eerst de [H3O+] in mol L–1. Zie ook
de bronnen 12 en 13.
Het is een reagens op koolstofdioxide, CO2(g).
b Gebruik Binas om achter de systematische naam
van kalkwater te komen. Kijk ook nog eens naar
opdracht 25.
a Antwoord: 1,47
3,410–2 M zoutzuur levert [H3O+] = 3,410–2
mol L –1.
pH = – log(3,410–2) = 1,47
Kalkwater is een calciumhydroxide-oplossing, dus
Ca2+(aq) + 2 OH–(aq). Je kunt deze oplossing op
twee manieren maken: door calciumhydroxide op
te lossen in water en door calciumoxide te laten
reageren met water.
b Antwoord: 2,25
Als je salpeterzuur in water oplost, heb je de
reactievergelijking:
HNO3(l) + H2O(l) H3O+(aq) + NO3–(aq)
Dus 1,0 mol salpeterzuur levert 1,0 mol H3O+(aq).
5,63 x 10–3 M salpeterzuuroplossing levert [H3O+] =
5,63 x 10–3 mol L–1.
pH = – log(5,63 x 10–3) = 2,25
Ca2+(aq) + 2 OH–(aq)
c Ca(OH)2(s)
CaO(s) + H2O(l) Ca2+(aq) + 2 OH–(aq)
water
29
zuur
kan H+ afstaan
oplossing pH < 7
oplossing kleurt
lakmoes rood
oplossing reageert met
magnesium; er ontstaat
waterstof
base
kan H+ opnemen
oplossing pH > 7
oplossing kleurt
lakmoes blauw
oplossing reageert niet
met magnesium
33
[H3O+] = 0,60 mol L–1
pH = – log[H3O+] = –log 0,60 = 0,22
34
30a De formule van lithiumhydride is LiH. In de
oplossing komen Li+ ionen voor. De formule van
het hydride-ion moet dan wel H– zijn.
b [H3O+] = 10–4,20 = 6,3 x 10–5 mol L–1
c [H3O+] = 10–(–0,26) = 100,26 = 1,8 mol L–1
35
c Welke stof zal ontstaan als het hydride-ion een
H+ion bindt?
8
0,350
0,15
1,0
…
Er is dus (0,15 x 1,0) : 0,350 = 0,4286 mol H3O+
pH = – log [H3O+] = 0,37
Wat doet een watermolecuul als het reageert met
een molecuul van een zuur HZ?
Wat doet een watermolecuul als het reageert met
een base B?
Als water reageert met een zuur, HZ, nemen de
watermoleculen de H+ ionen op. Er ontstaat H3O+.
HZ + H2O H3O+ + Z–.
Als water reageert met een base, B, staan de
watermoleculen H+ ionen af. Er ontstaat OH–.
B + H2O BH+ + OH–.
Watermoleculen zijn dus heel bijzonder: ze
hebben twee ‘gezichten’, ze kunnen H+ afstaan en
ze kunnen H+ opnemen.
Er zitten dus twee stappen in de berekening:
1) bereken [H3O+] (in mol L–1)
2) bereken de pH: – log[H3O+]
a antwoord: 0,37
aantal L
aantal mol
Als het hydride-ion, H–, met een H+ ion reageert,
ontstaat H2.
31
Zie bron 14. Algemeen geldt dus:
als de pH = a, dan is [H3O+] = 10–a.
a [H3O+] = 10–2,21 = 6,2 x 10–3 mol L–1
b Kijk goed naar de reactievergelijking in bron 11.
Vergelijk het eens met de reactie van calciumoxide
met water. Kijk ook nog eens naar opdracht 23.
Het H– ion kan uitstekend een H+ ion binden. Het
hydride-ion is dus de base.
Om de pH te berekenen moet je –log[H3O +]
nemen.
b Denk eraan dat 1 mol H2SO4 twee mol H + kan
afstaan.
Antwoord: 1,17
[H3O+] = 2 x 3,4 x 10–2 = 6,8 x 10–2 mol L–1
pH = – log 6,8 x 10–2 = 1,17
36
Er zijn drie deelstappen: gram omrekenen in mol,
omrekenen van 2,50 L naar 1,00 L en tot slot de
pH uitrekenen.
Antwoord: 0,544
stap 1:
aantal gram salpeterzuur 63,01
aantal mol salpeterzuur 1,00
45,0
....
Er is dus 45,0 : 63,01 = 0,7142 mol salpeterzuur
stap 2:
Dat betekent 0,7142 : 2,50 = 0,2857 mol L–1
© Noordhoff Uitgevers bv
Pulsar – Chemie vwo bovenbouw deel 2 Uitwerkingen Hoofdstuk 9
stap 3:
pH = – log 0,2857 = 0,544
37a Zie bron 14. Algemeen geldt dus:
als de pH = a, dan is [H3O+] = 10–a.
[H3O+] = 10–3,37 = 4,27 x 10–4 mol L–1
b De oplossing wordt 100 x verdund. De
concentratie wordt 100 x zo klein.
Dus [H3O+] = 4,27 x 10–6 mol L–1
c pH = – log 4,27 x 10–6 = 5,37
d De pH stijgt van 3,37 naar 5,37.
De pH-verandering is dus gelijk aan 2,00.
Als je een zuur 100 x verdunt, stijgt de pH met 2
(dat is log 100).
38 a De oplossing wordt steeds 10x verdund.
De concentratie wordt dan 10 x zo klein.
De pH stijgt steeds met log 10 = 1,00.
O+]
In oplossing 1 is [H3
= 1,00.
De pH is dan –log 1,00 = 0,00
In oplossing 2 is [H3O+] = 0,10 mol L–1
pH = – log[H3O+] = –log 0,10 = 1,00
39a De pH van zuiver water is 7,00.
b Gebruik zo nodig een verhoudingstabel.
aantal mol H3O+
aantal mL zoutzuur
1,04
1000
...
0,10
Er is dus (1,04 x 0,10) : 1000 = 1,04 x 10–4 mol
H3O+ aanwezig in 0,10 mL 1,04 M zoutzuur.
c Het aantal mol H3O+ is bekend. Bereken het
volume en vervolgens [H3O+].
Het volume wordt 1000 + 0,10 = 1000,10 mL (als
je dit afrondt, komt er weer 1000 uit!) = 1,00010 L.
Dus [H3O+] = 1,04 x 10–4 mol : 1,00010 =
1,04 x 10–4 mol L–1.
In oplossing 3 is [H3O+] = 0,010 mol L–1
pH = – log[H3O+] = –log 0,010 = 2,00
d pH = – log 1,04 x 10–4 = 3,98
In oplossing 4 is [H3O+] = 0,0010 mol L–1
pH = – log[H3O+] = – log 0,0010 = 3,00
e De pH daalt dus van 7,00 naar 3,98: een
verandering van 3,02.
In oplossing 5 is [H3O+] = 0,00010 mol L–1.
pH = – log[H3O+] = – log 0,00010 = 4,00
b
40a Zie ook opdracht 22. Bereken [H3O+] als de
hoeveelheid salpeterzuur opgelost is in de
berekende hoeveelheid Rijnwater.
Antwoord: 1,79
Volgens opdracht 22 is er sprake van
1,4 x 106 L salpeterzuuroplossing met een
molariteit van 14 mol L–1. Er is dan 14 x (1,4 x 106)
= 1,96 x 107 mol HNO3; dus ook 1,96 x 107 mol
H3O+.
Er stroomt 2000 m3 water per seconde, dus
2000 x 600 = 1,2 x 106 m3 water per 10 minuten
(= 600 seconden). Dat is 1,2 x 109 L. Daar komt
1,4 x 106 L salpeterzuuroplossing bij, maar die is
ten opzichte van deze grote hoeveelheid water te
verwaarlozen. In 1,2 x 109 liter Rijnwater is dan
1,96 x 107 mol H3O+ aanwezig.
[H3O+] = 1,96 x 107 mol : 1,2 x 109 =
0,0163 mol L–1.
De pH is dan – log 0,0163 = 1,79.
b Als de pH met één eenheid moet stijgen, moet je
10x verdunnen. De concentratie wordt 10x zo
klein. Je moet dan de hoeveelheid salpeterzuur
oplossen in 10x zoveel water.
Antwoord: 90 minuten.
De hoeveelheid water moet 10 x zo groot worden.
In plaats van 1,2 x 106 m3 water is er 12 x 106 m3
water nodig. Er moet 12 x 106 – 1,2 x 106 =
10,8 x 106 m3 water nodig. Per minuut stroomt er
© Noordhoff Uitgevers bv
9
Pulsar – Chemie vwo bovenbouw deel 2 Uitwerkingen Hoofdstuk 9
stap 2: [OH–] = 0,920 : 3,6 = 0,256 mol L–1
stap 3: pOH = – log 0,256 = 0,59
stap 4: pH = 14,00 – 0,59 = 13,41
2000 x 60 = 1,2 x 105 m3 water.
Het kost dus 10,8 x 106 : 1,2 x 105 = 90 minuten
om de pH één eenheid hoger te laten worden.
46
■■
9.5 De pH van basische oplossingen
41
Bereken steeds eerst [OH –] in mol L –1.
a Antwoord: 2,91
1,2210–3 M natronloog:
[OH–] = 1,2210–3 mol L –1
pOH = – log(1,2210–3) = 2,91
Antwoord: 3,8 x 102 mL
pH = 12,60 → pOH = 14,00 – 12,60 = 1,40 →
[OH–] = 10–1,40 = 4,0 x 10–2 mol L–1.
b Geef de notatie van kaliloog.
pH = 11,30 → pOH = 14,00 – 11,30 = 2,70 →
[OH–] = 10–2,70 = 2,0 x 10–3 mol L–1.
Antwoord: –0,30
2,0 M kaliloog: [OH– ] = 2,0 mol L –1
pOH = – log (2,0) = –0,30
42
[OH–] in de eerste oplossing is
4,0 x 10–2 : 2,0 x 10–3 = 20 x zo geconcentreerd
als de tweede oplossing. Fred moet de eerste
oplossing dus 20 x verdunnen. Het volume moet
dus 20 x zo groot worden. Bij 20,0 mL natronloog
moet dus 380 mL water. Het volume wordt dan
20,0 + 380 = 400 mL. In het juiste aantal
significante cijfers: 3,8 x 102 mL.
Gebruik de regel dat pH + pOH = 14,00
a pOH = 2,91. Dus pH = 14,00 – 2,91 = 11,09
b pOH = –0,30. De pH = 14,00 – (–0,30) = 14,30
43
Er zijn twee stappen: bereken eerst pOH, daarna
[OH–].
Deze opdracht lijkt op opdracht 39. De aanpak is
vergelijkbaar.
a Je moet weten: hoeveel mol OH– is aanwezig in
0,10 mL 1,34 M natronloog. Daarna kun je [OH–]
uitrekenen, dan de pOH en tenslotte de pH.
b Antwoord: 5,0 x 10–4 mol L–1
pOH = 14,00 – 10,7 = 3,3
[OH–] = 10–3,3 = 5,0 x 10–4 mol L–1
b Antwoord: 10,13
aantal mL natronloog
aantal mol OH–
Ga met behulp van tabel 66A na wat de
samenstelling van kalkwater is. Bereken eerst
[OH–], dan de pOH en ten slotte de pH.
Antwoord: 10,68
Kalkwater is een calciumhydroxide-oplossing:
Ca2+(aq) + 2 OH–(aq). Uit 1,00 mol
calciumhydroxide ontstaat dus 2,00 mol OH–.
In 2,410–4 M kalkwater is [OH–] =
4,810–4 mol L–1.
pOH = – log(4,810–4) = 3,32
pH = 14,00 – 3,32 = 10,68
45
47
a Antwoord: 0,28 mol L–1
pOH = 14,00 – 13,45 = 0,55
[OH–] = 10–0,55 = 0,28 mol L–1
c Antwoord: 40 mol L–1
pOH = 14,00 – 15,6 = –1,6
[OH–] = 101,6 = 40 mol L–1
44
Je kunt nooit rechtstreeks met de pH zelf
berekeningen doen. Omdat pH > 7 is het een
basische oplossing. Daarom moet je de pH eerst
omrekenen in pOH en [OH–] Je moet [OH–] in
beide oplossingen met elkaar vergelijken.
Werk in stappen: reken het gegeven om in mol,
dan omrekenen naar mol L–1, dan de pOH en tot
slot de pH.
Antwoord: 13,41
stap 1:
10
aantal gram NaOH
aantal mol NaOH
40,00
1,000
36,8
..
Er is dus 36,8 : 40,00 = 0,920 mol NaOH en dus
ook 0,920 mol OH–.
© Noordhoff Uitgevers bv
1000
1,34
0,10
...
Er is dus (1,34 x 0,10) : 1000 = 1,34 x 10–4 mol
OH–. Deze hoeveelheid bevindt zich in 1000 +
0,10 mL oplossing. Dit is 1,00 L.
[OH–] = 1,34 x 10–4 mol L–1.
De pOH = –log 1,34 x 10–4 = 3,87.
De pH is dan 14,00 – 3,87 = 10,13.
48a Natronloog is de naam van een oplossing.
Vervoerde de vrachtauto een oplossing?
De auto vervoerde korrels in zakken. Het was dus
vaste natriumhydroxide en geen natronloog.
b Bereken eerst de pOH, daarna de pH.
Volgens tabel 45B lost er 28,5 mol NaOH op per
kg water. Als er bij het oplossen geen volumeverandering optreedt, mag je aannemen dat er
28,5 mol NaOH per liter is opgelost.
Dus [OH–] = 28,5 mol L–1.
pOH = – log 28,5 = –1,45
pH = 14,00 – (–1,45) = 15,45
Pulsar – Chemie vwo bovenbouw deel 2 Uitwerkingen Hoofdstuk 9
– zwaveldioxide verwijderen uit rookgassen: het
zwaveldioxide komt niet in het milieu terecht.
– alternatieve brandstoffen gebruiken: er ontstaat
geen zwaveldioxide.
c Wat zou jij doen als je korrelachtig materiaal moet
opruimen?
De brandweer zal geen water gebruikt hebben.
Dan ontstaat geconcentreerde loog en dat is zeer
schadelijk voor het milieu. Met bezem en schop
kan het materiaal goed opgeruimd worden.
56a Integendeel. In de regels 3 en 4 staat dat de
achteruitgang van de heide door overbemesting
plaatsvindt.
–
49
b Er zijn verschillende mogelijkheden: ammoniak,
NH3 en stikstofoxiden.
■■
9.6 Verzuring van het milieu
50
De industrie produceert zwaveldioxide bij de
verbranding van zwavelhoudende brandstoffen.
Uit zwaveldioxide ontstaat zwavelzuur.
Het verkeer zorgt voor stikstofoxiden, die met
water en zuurstof reageren tot salpeterzuur.
De landbouw produceert ammoniak uit mest.
Bacteriën zetten dit om in salpeterzuur.
c Kijk bij kalksteen, kalkspaat en kalkwater.
51
52
Bij beperking van de wereldbevolking is er minder
behoefte aan energie, vervoer en voedsel. Uit
antwoord op opdracht 50 blijkt dat verkeer en
landbouw voor verzuring van het milieu kunnen
zorgen.
Het gaat om calciumcarbonaat of
calciumhydroxide. In deze stoffen komen basen
voor, namelijk CO32– of OH–. Deze basen kunnen
H+ ionen
binden.
■■
9.7 Zuur-base reacties
57a Je ruikt ammoniak.
b Er ontstaat een vloeistof.
Veel veroorzakers van verzuring zijn gasvormig.
c Maak een lijstje van de aanwezige ionen.
Je mengt Ba2+, OH–, NH4+, Cl–.
Hiervan kan NH4+, het ammoniumion, een H+ ion
afstaan.
Zwaveldioxide en stikstofoxiden kunnen door de
wind overal heen geblazen worden. De
verontreiniging is dus grensoverschrijdend. Ook
handel en industrie werken internationaal. Je kunt
op allerlei manieren milieuproblemen exporteren
en importeren.
d Zie het lijstje bij c.
OH–, het hydroxide-ion, kan een H+ ion opnemen.
53 a Het betekent dat fabrikanten maatregelen moeten
nemen om de uitstoot van schadelijke stoffen te
verminderen en deze maatregelen kosten (veel)
geld. Hierdoor worden de producten van deze
fabrikanten duurder en dat is nadelig voor hun
concurrentiepositie.
58
2 Als de H3O+ ionen verdwijnen, wordt de oplossing
minder zuur.
3 Natronloog bevat Na+ ionen en OH– ionen.
b Ontwikkelingslanden hebben het geld niet om de
maatregelen te betalen die moeten leiden tot een
vermindering van de uitstoot van schadelijke
stoffen.
54
55
Vragen bij de proef
1 Zoutzuur bevat H3O+ ionen en Cl– ionen.
4 De OH– ionen kunnen reageren met H3O+ ionen.
5 H3O+(aq) + OH–(aq) 2 H2O(l)
Dat mag je zelf doen.
6 De Na+ ionen en Cl– ionen vormen samen NaCl(s).
Er blijft dus vaste natriumchloride over.
Lees eerst het artikel in bron 21 goed.
a Lees de laatste zin van het artikel.
30 miljoen ton
b S(s) + O2(g) → SO2(g)
c Zure regen is volgens de regels 4 en 5 neerslag
met een pH die lager is dan het natuurlijke niveau
van 5,6.
d Zwaveldioxide is volgens het artikel verreweg de
belangrijkste veroorzaker van zure regen in China.
Geschikte maatregelen zijn:
– zwavelarme brandstof gebruiken: er ontstaat
minder zwaveldioxide.
© Noordhoff Uitgevers bv
59
Vragen bij de proef
1 Als de oplossing niet meer zuur is, zijn de H3O+
ionen verdwenen.
2 Welke ionen komen voor in calciumcarbonaat?
Calciumcarbonaat is opgebouwd uit Ca2+ en CO32–
Het CO32– ion kan twee H+ ionen binden.
11
3 Kijk in bron 5. Welke informatie is daar te vinden
over koolzuur?
Er ontstaat koolzuur, H2CO3, dat ontleedt in water
en koolstofdioxide. Het gas is dus vrijwel zeker
koolstofdioxide.
Pulsar – Chemie vwo bovenbouw deel 2 Uitwerkingen Hoofdstuk 9
60
Gebruik de aanpak zoals die in bron 25 is
beschreven.
– Aanwezig: zoutzuur: H3O+(aq), Cl–(aq)
kalkwater: Ca2+(aq), OH–(aq)
– Het zuur is H3O+(aq), de base is OH–(aq)
– H3O+ kan één H+ afstaan, OH– kan één H+
opnemen.
– H3O+(aq) + OH–(aq) 2 H2O(l)
61
■■
9.8 Een kwantitatieve analyse
66
Wat meten de leerlingen?
De leerlingen meten de pH. Daaruit is te
berekenen hoeveel mol H+ per liter slootwater
aanwezig is. Er worden hoeveelheden gemeten.
Het is dus een kwantitatieve analyse.
67
Gebruik de aanpak zoals die in bron 25 is
beschreven.
a Er worden getallen (km per uur) gemeten. Het is
dus een kwantitatieve analyse.
– natriumdiwaterstoffosfaat, NaH2PO4(s), en
natriumwaterstofcarbonaat, NaHCO3
– H2PO4– in NaH2PO4 is het zuur, omdat het
overgaat in monowaterstoffosfaat, HPO42–
– HCO3– in NaHCO3 is dan de base; er ontstaat
dan CO2(g) (zie bron 26)
– H2PO4– staat één H+ af, HCO3– neemt één H+
op.
– NaH2PO4(s) + NaHCO3(s)
Na2HPO4(s) + H2O(g) + CO2(g)
b Hangt van de meetmethode af. Als alleen wordt
gekeken of er geluidsoverlast is en niet hoeveel,
dan is het een kwalitatieve analyse. Als er ook
getallen gemeten (decibel) gemeten worden, is het
een kwantitatieve analyse.
c Er wordt gemeten welke waarde de temperatuur
heeft. Het is dus een kwantitatieve analyse.
62a Schrijf beide notaties in ionen.
Oplossing van natriumsulfide: 2 Na+(aq) + S2–(aq)
verdund zwavelzuur: 2 H3O+(aq) + SO42–(aq)
d Er wordt gemeten hoeveel bacteriën aanwezig
zijn. Het is dus een kwantitatieve analyse.
68
Dan zou je na iedere toegevoegde hoeveelheid, al
is het maar een druppel, te lang moeten wachten.
Als je dat dan niet doet, zul je heel gemakkelijk te
veel stof toevoegen. Hierdoor wordt de uitslag van
de meting onbetrouwbaar.
69
In onderstaande tabel staat een voorbeeld. Het is
best mogelijk dat jij andere getallen hebt gevonden.
b Het zuur is H3O+(aq), de base is S2–(aq).
c S2–(aq) kan twee H+ opnemen. Dan ontstaat
H2S(g), waterstofsulfide. Dit gas stinkt naar rotte
eieren.
d 2 H3O+(aq) + S2–(aq) 2 H2O(l) + H2S(g)
63a Gebruik de aanpak zoals die in bron 25 is
beschreven. Zie ook opdracht 61.
– azijnzuur: CH3COOH. Azijn, de oplossing van
azijnzuur, bevat dan H3O+(aq) en CH3COO–(aq)
– bakpoeder bevat onder andere NaHCO3(s)
– het zuur is H3O+(aq), de base is HCO3– in
NaHCO3(s)
– H3O+ kan één H+ afstaan, HCO3– neemt één H+
op.
– H3O+(aq) + NaHCO3(s) Na+(aq) + 2 H2O(l) +
CO2(g)
b Welke producten ontstaan bij de reactie? Welk
product kan invloed hebben op de verbranding?
Het waxinelichtje gaat uit. De oorzaak is dat er
gebrek aan zuurstof ontstaat. Het gas
koolstofdioxide is zwaarder dan lucht en verzamelt
zich onderin het bekerglas. Als het gas de vlam
bereikt, zal de vlam doven.
12
64
–
65
–
© Noordhoff Uitgevers bv
Ga steeds na of er wel of geen hoeveelheid wordt
gemeten. Zo ja, dan is er sprake van een
kwantitatieve analyse.
molariteit
natronloog 0,12 M
zoutzuur
15,0
8,0
7,0
15,5
8,3
7,2
proef massa voor (g)
1
massa na (g)
toegevoegd
proef massa voor (g)
2
massa na (g)
toegevoegd (g)
natronloog
16,0
7,0
9,0
15,6
6,4
9,2
Volg de aanpak van bron 31.
Antwoord: 0,15 mol L–1
1 H3O+(aq) + OH–(aq) 2 H2O(l)
2 Van natronloog weet je de hoeveelheid en de
molariteit. Dat is dus de gegeven stof. De
gevraagde molariteit is die van zoutzuur.
3 H3O+(aq) : OH–(aq) = 1 : 1
4 Er is gemiddeld 9,1 gram natronloog gebruikt.
Neem aan dat de dichtheid van natronloog 1,00 g
mL–1 is.
aantal mol OH–
aantal L oplossing
0,12
1,00
....
9,1 x 10–3
Er is dus 0,12 x 9,1 x 10–3 mol = 1,092 x 10–3 mol
NaOH toegevoegd.
5 Er was dus ook 1,092 x 10–3 mol H3O+ in 7,1
gram zoutzuur aanwezig (gemiddeld).
Pulsar – Chemie vwo bovenbouw deel 2 Uitwerkingen Hoofdstuk 9
Ook bij zoutzuur nemen we aan dat de dichtheid
1,00 g mL–1 is
6
aantal mol H3O+
aantal L zoutzuur
1,092 x 10–3 ...
7,1 x 10–3
1,0
Er is dus (1,092 x 10–3 x 1,0) : 7,1 x 10–3 mol L–1 =
0,1538 mol L–1
7 Met deze meetresultaten kun je niet meer dan
twee significante cijfers geven. Het antwoord is
dus 0,15 mol L–1.
70
laat reageren. De oplossingen moeten ongeveer
even
geconcentreerd zijn. Als de ene oplossing veel
geconcentreerder is dan de andere oplossing, heb
je van de ene oplossing heel veel en van de
andere heel weinig nodig. Dat bevordert de
nauwkeurigheid van je bepaling niet.
Ga na welke waarde de pH heeft als precies al het
zoutzuur met natronloog gereageerd heeft.
a Aan het begin van de titratie is de oplossing
duidelijk zuur. Druppel natronloog toe en meet
nauwkeurig hoeveel mL je toevoegt. Als
natronloog wordt toegedruppeld, zal de pH gaan
stijgen. Ga hiermee door, totdat de pH van de
oplossing (vrijwel) gelijk is aan 7,0. Voer de
berekening van opdracht 69 weer uit.
73
Antwoord: 68,5 massaprocent.
1 CO32–(aq) + 2 H3O+(aq) CO2(g) + 3 H2O(l)
2 Gegeven: van zoutzuur is de molariteit en de
hoeveelheid bekend.
Gevraagd: hoeveelheid carbonaat.
3 CO32– : H3O+ = 1 : 2
CO32– : Na2CO3 = 1 : 1; hieruit volgt
Na2CO3 : H3O+ = 1 : 2
4 15,45 ml 0,113 M zoutzuur bevat 15,450,113 =
1,746 x 10–3 mol H3O+.
5 Er is dus 1,746 x 10–3 : 2 = 0,873 x 10–3 mol CO32–
in de oplossing aanwezig.
b –
6 Er was dus ook 0,873 x 10–3 mol
natriumcarbonaat aanwezig.
71a Let goed op de aanpak in opdracht 69.
Er heeft 28,32 – 14,28 = 14,04 gram
zwavelzuuroplossing gereageerd met 32,38 –
11,83 = 20,55 gram natronloog.
7 De molaire massa van Na2CO3 is 106,0 g mol–1.
aantal mol Na2CO3
aantal gram Na2CO3
b Neem weer aan dat de dichtheid van beide
oplossing gelijk is aan 1,00 g mL–1.
Er is dus 9,2510–2 g natriumcarbonaat aanwezig
in 0,135 g soda.
Er reageert 14,04 mL zwavelzuuroplossing met
20,55 mL natronloog.
c Gebruik een verhoudingstabel.
aantal L natronloog
aantal mol OH–
1,00
0,106
20,55 x 10–3
...
8 Het massapercentage natriumcarbonaat in deze soda
is:
9,25 10–2
100% = 68,5 massaprocent
0,135
Alle gegevens zijn in minimaal drie significante
cijfers, dus is het antwoord 68,5 massaprocent.
Er is (onafgerond) 2,1783 x 10–3 mol OH–
toegevoegd.
d Er was dus ook 2,1783 x 10–3 mol H3O+ aanwezig
per 14,04 mL zwavelzuuroplossing.
e Gebruik een verhoudingstabel en denk eraan dat
1 mol zwavelzuur twee mol H+ kan afstaan.
aantal L zwavelzuuroplossing
aantal mol H3O+
14,04 x 10–3
2,1783 ×
10–3
1,00
...
Er is dus 0,15515 mol H3O+ per liter. Dit is
afkomstig van 0,07757 mol H2SO4.
De gevraagde molariteit is dus 0,0776 mol L–1.
(in drie significante cijfers, omdat alle gegevens in
minstens drie cijfers nauwkeurig gegeven zijn).
1,000 0,873 x 10–3
106,0 ...
■■
Op weg naar het proefwerk
1 a Een zuur is een deeltje dat H+ ionen kan afstaan.
b In bron 5 staan de formules van de zuren die je
moet kennen.
Salpeterzuur, HNO3
Zwavelzuur, H2SO4
Fosforzuur, H3PO4
c Een zure oplossing bevat H3O+ ionen, kleurt
lakmoes rood, reageert met magnesium, geleidt
de stroom.
13
2 a In bron 8 staan de basen die je moet kennen.
72
Je kunt de titratie net zo uitvoeren als in opdracht
69.
Houd bij je werkplan rekening met de
concentraties van de oplossingen die je met elkaar
© Noordhoff Uitgevers bv
Een base is een deeltje dat H+ ionen kan
opnemen.
Pulsar – Chemie vwo bovenbouw deel 2 Uitwerkingen Hoofdstuk 9
c Calciumcarbonaat bevat de base CO32–. Dit kan
per ion 2 H+ ionen binden en er ontstaat koolzuur.
Dit ontleedt in water en koolstofdioxide.
b Ammoniak, NH3
Hydroxide-ion, OH–
Carbonaation, CO32–
CaCO3(s) + 2 H3O+(aq) + SO42–(aq)
CaSO4. 2 H2O(s) + H2O(l) + CO2(g)
c Iedere basische oplossing bevat OH– ionen.
3
–
4
Schrijf de ionen op die in de oplossingen
voorkomen. Ga na welk ion als zuur kan optreden
en welk ion als base.
9 a Denk niet alleen aan zuur-base reacties, maar ook
aan tabel 45A.
Het onderstaande antwoord is een voorbeeld. Er
zijn ook andere antwoorden mogelijk.
Volgens tabel 45A van Binas is calciumfosfaat
slecht oplosbaar in water en calciumsulfaat matig
oplosbaar. Voeg een schepje kunstmest toe aan
een hoeveelheid water. Roer goed en filtreer de
suspensie. Damp het filtraat in. Als er vrijwel geen
residu overblijft, is er dus vrijwel niets opgelost en
was het calciumfosfaat. Als er wel residu overblijft,
is er wel wat opgelost en was het calciumsulfaat.
Oplossing I : Na+(aq) en HSO4–(aq)
Oplossing II: Na+(aq) en CO32–(aq)
Oplossing III: Na+(aq) en NO3–(aq)
Het enige ion dat een H+ ion kan afstaan is het
HSO4– ion. In oplossing I zullen dus H3O+ ionen
voorkomen en zal de pH < 7 zijn.
Oplossing II bevat de base CO32–. Dit kan met
water reageren. Er ontstaan dan OH– ionen en de
pH zal > 7 zijn.
Oplossing III bevat geen zuur of base en de pH zal
gelijk zijn aan 7.
b Deze antwoorden moeten in overeenstemming zijn
met je antwoord in a.
water
Ca2+(aq) + SO42–(aq)
indampen
CaSO4(s)
Ca2+(aq) + SO42–(aq)
CaSO4(s)
5 a Zoek twee indicatoren met een omslagtraject in de
buurt van pH = 9,8.
Je kunt thymolblauw en alizariengeel-R gebruiken.
Thymolblauw wordt blauw: dus pH > 9,6
Alizariengeel-R wordt lichtgeel, dus pH < 10,1
Dus 9,6 < pH < 10,1.
10
Antwoord: 8,50 massaprocent
Stap 2
gegeven: natronloog (30,20 mL; 1,10 M)
gevraagd: citroenzuur
Stap 3
citroenzuur : natronloog = 1 : 3.
Stap 4
30,20 mL 1,10 M natronloog bevat 33,2 mmol
OH–(aq).
Stap 5
Er is dus 33,2 : 3 = 11,1 mmol citroenzuur in
25,00 mL onderzochte limonade.
Stap 6
11,1 mmol citroenzuur komt overeen met
11,1192,0 = 2,13103 mg = 2,13 g citroenzuur.
Deze 2,13 g citroenzuur bevindt zich in 25,00 g
(dichtheid is 1,00 g mL–1) limonade.
Het massapercentage is:
2,13
100% = 8,50 massaprocent
25,00
Stap 7
Alle gegevens zijn in minimaal drie significante
cijfers, dus is het antwoord 8,50 massaprocent.
b Een base reageert met water, waarbij OH– ionen
ontstaan.
HS–(aq) + H2O(l) H2S(g) + OH–(aq)
6
Schrijf per indicator je conclusie op en combineer
de drie uitkomsten.
buis 1: pH < 6,8
buis 2: pH < 8,0
buis 3: pH < 3,8
Dus de pH van 7-UP is kleiner dan 3,8.
7 a Bereken eerst [H3O+] en dan de pH.
0,23 M zoutzuur bevat 0,23 mol H3O+ per liter.
pH = –log [H3O+] = 0,64.
b Bereken [OH–], dan de pOH en tot slot de pH.
Natronloog is een oplossing van NaOH.
In 4,8 x 10–2 M NaOH is [OH–] = 4,8 x 10–2 mol L–1
pOH = – log 4,8 x 10–2 = 1,32.
pH = 14,00 – 1,32 = 12,68.
11
c Bereken eerst [H3O+] en dan de pH.
14
1,0 mol zwavelzuur kan 2,0 mol H+ afstaan.
In 3,78 x 10–3 M zwavelzuuroplossing is dus
[H3O+] = 2 x 3,78 x 10–3 = 7,56 x 10–3 mol L–1.
pH = – log 7,56 x 10–3 = 2,12.
8 a 2 H3O+(aq) + SO42–(aq)
b calciumsulfaatdihydraat.
© Noordhoff Uitgevers bv
De eerste stap van de rekenstappen kun je niet
doen, omdat je de formule van citroenzuur niet
weet. De andere stappen kun je wel gebruiken!
Denk niet alleen aan zuur-base reacties, maar ook
aan tabel 45A.
Voeg aan elk van de drie witte stoffen een beetje
water toe. De stof die niet oplost in water, is
calciumcarbonaat.
Neem van de overgebleven twee stoffen evenveel
gram en voeg aan beide eenzelfde hoeveelheid
zoutzuur toe. Vang het gevormde CO2 op. De stof
waarbij het minste gas ontstaat, is Na2CO3.
Pulsar – Chemie vwo bovenbouw deel 2 Uitwerkingen Hoofdstuk 9
Verklaring: CO32– heeft 2 H+ nodig om koolstofdioxide te kunnen vormen. HCO3– heeft hiervoor
maar 1 H+ nodig.
12 a Wat is het verband tussen een zuur en het
zuurrestion?
Citr3– (let op de lading 3-!)
b Welke base levert bij een zuur-base reactie
CO2(g) op?
Omdat bij de zuur-base reactie CO2(g) ontstaat
moet de base het carbonaation of het
waterstofcarbonaation zijn. Het zout is dus
natriumcarbonaat of natriumwaterstofcarbonaat;
formule Na2CO3(s) of NaHCO3(s).
c Voor de overdracht van H+ moeten het zuur en de
base goed met elkaar in contact staan. Als je de
tablet in water brengt, kunnen de ingrediënten
oplossen en is het contact beter mogelijk.
d Welke ionen ontstaan als citroenzuur in water
komt?
Wat is het zuur, wat is de base en hoeveel H+
wordt overgedragen?
Als citroenzuur in water komt, ontstaan H3O+
ionen, deze zijn dan het zuur. CO32– ionen zijn de
base.
2 H3O+ (aq) + CO32–(aq) CO2(aq) + 3 H2O(l)
15
© Noordhoff Uitgevers bv





