Aromatische chemie – benzeen en benzeenderivaten
1. Inleiding
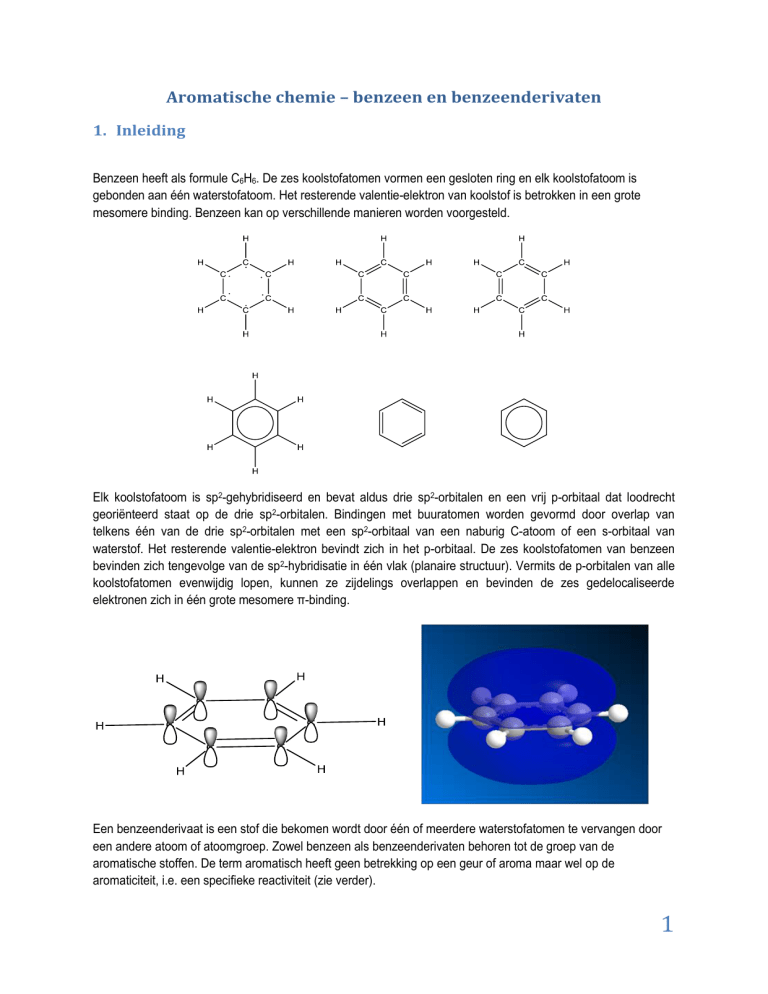
Benzeen heeft als formule C6H6. De zes koolstofatomen vormen een gesloten ring en elk koolstofatoom is
gebonden aan één waterstofatoom. Het resterende valentie-elektron van koolstof is betrokken in een grote
mesomere binding. Benzeen kan op verschillende manieren worden voorgesteld.
Elk koolstofatoom is sp2-gehybridiseerd en bevat aldus drie sp2-orbitalen en een vrij p-orbitaal dat loodrecht
georiënteerd staat op de drie sp2-orbitalen. Bindingen met buuratomen worden gevormd door overlap van
telkens één van de drie sp2-orbitalen met een sp2-orbitaal van een naburig C-atoom of een s-orbitaal van
waterstof. Het resterende valentie-elektron bevindt zich in het p-orbitaal. De zes koolstofatomen van benzeen
bevinden zich tengevolge van de sp2-hybridisatie in één vlak (planaire structuur). Vermits de p-orbitalen van alle
koolstofatomen evenwijdig lopen, kunnen ze zijdelings overlappen en bevinden de zes gedelocaliseerde
elektronen zich in één grote mesomere π-binding.
Een benzeenderivaat is een stof die bekomen wordt door één of meerdere waterstofatomen te vervangen door
een andere atoom of atoomgroep. Zowel benzeen als benzeenderivaten behoren tot de groep van de
aromatische stoffen. De term aromatisch heeft geen betrekking op een geur of aroma maar wel op de
aromaticiteit, i.e. een specifieke reactiviteit (zie verder).
1
Als het benzeenderivaat enkel is opgebouwd uit koolstof- en waterstofatomen, spreekt men van een aromatisch
koolwaterstof of areen.
2. Naamgeving van benzeenderivaten
2.1.
Arenen
Indien de substituenten enkel bestaan uit alkylgroepen, wordt de naam gevormd door de naam van de
alkylgroep(en) in alfabetische volgorde voor benzeen te plaatsen, eventueel vergezeld van een plaatsnummer
(dat zo klein mogelijk dient te zijn) of een voorvoegsel (di-, tri, tetra-, penta-, hexa-) dat het aantal van de
groepen weergeeft. Indien er slechts twee substituenten zijn, worden de relatieve posities van de groepen
weergegeven door de prefixen ortho (of kortweg ‘o’ - voor een 1, 2 positie), meta (of kortweg ‘m’ - voor een 1, 3
positie) en para (of kortweg ‘p’ - voor een 1, 4 positie).
Wanneer beide ringen een koolstof-koolstofbinding gemeenschappelijk hebben, zijn de beide ringen
gecondenseerd. In onderstaande voorstelling is de rechter-afbeelding foutief: in naftaleen zijn slechts tien πelektronen aanwezig, een cirkel in de benzeenring stelt echter zes gedelocaliseerde elektronen voor (dus de
twee ringen stellen twaalf elektronen voor, waar er slechts tien aanwezig zijn.
2.2.
Benzeenderivaten met andere atomen dan koolstof en waterstof
Als atomen of atoomgroepen eenvoudig zijn, worden ze vermeld in alfabetische volgorde voor benzeen met
plaatsnummers (of indien slechts twee substituenten aanwezig zijn met de prefixen ortho/meta/para (of o, m, p))
en eventueel een voorvoegsel (di, tri, tetra, penta, hexa) dat het aantal van elk substituent weergeeft.
2
3. Aromaticiteit
De term aromaticiteit heeft betrekking op de specifieke reactiviteit van benzeen(derivaten). Deze reactiviteit is het
gevolg van het feit dat één mesomere binding alle koolstofatomen in de ringstructuur verbindt. Hiervoor moeten
alle (C-)atomen over een vrij p-orbitaal beschikken dat loodrecht op hetzelfde vlak staat. De term aromaticiteit
slaat op de bijzondere stabiliteit tengevolge van de grote mesomere binding in de ringstructuur.
Stoffen met π-bindingen zijn doorgaans behoorlijk reactief en ondergaan additiereacties, waarbij de elektronen
afkomstig van de π-binding gebruikt worden om atomen of atoomgroepen op de koolstofatomen te binden.
Aromatische stoffen zijn echter – ondanks de π-bindingen – weinig reactief. Dit komt omdat de delocalisatie van
de elektronen (mesomerie) over meerdere (C-)-atomen de stof een bijzondere stabiliteit geeft.
Een stof blijkt aromatisch te zijn, als 4n+2π-elektronen (waarbij n een natuurlijk getal moet voorstellen) over de
ringatomen zijn uitgesmeerd (dit is de regel van Hückel).
4. Fysische eigenschappen van benzeen en benzeenderivaten
Het kook- en smeltpunt van benzeen en benzeenderivaten is analoog als dat van alifatische koolwaterstoffen
met een gelijke molecuulmassa. De kookpunten nemen evenzo toe met toenemende molecuulmassa. Arenen
zijn apolair en daarom niet oplosbaar in water, wel in apolaire oplosmiddelen. Karakteristieke groepen als –OH, COH, -COOH, etc… hebben een belangrijke invloed op de fysische eigenschappen (zie daarvoor de theorie bij
alcoholen, carbonzuren, aldehyden en ketonen).
5. Chemische eigenschappen van benzeen en benzeenderivaten
5.1.
Inleiding
Omdat benzeen meervoudige bindingen bezit, verwacht men dat benzeen vooral elektrofiele additiereacties
ondergaat. Bij een additiereactie wordt echter de aromatische structuur en de bijhorende stabiliteit vernietigd.
Omwille van de aromaticiteit ondergaat benzeen daarom geen additiereacties, maar wel substitutiereacties
3
ondergaan. Het elektronenrijke karakter van de ring verklaart waarom vooral elektrofiele deeltjes de ring
benaderen.
5.2.
Elektrofiele substitutiereacties
5.2.1. Halogenering van benzeen
Bij een halogenering wordt een waterstofatoom gesubstitueerd door een halogeen (Br of Cl).
De halogenering van benzeen vereist de aanwezigheid van een katalysator, omdat de π-elektronen in
tegenstelling tot alkenen weinig polariseerbaar zijn. De katalysator helpt met het maken van een zeer elektrofiel
reagens.
5.2.2. Alkylering van benzeen
De alkylering van benzeen verloopt op een gelijkaardige manier. Een waterstofatoom wordt gesubstitueerd door
een alkylgroep.
5.2.3. Nitrering van benzeen
De nitrering van benzeen leidt tot de vorming van nitrobenzeen.
5.2.4. Sulfonering van benzeen
De sulfonering van benzeen leidt tot de vorming van benzeensulfonzuur. Als katalysator wordt zwavelzuur
gebruikt.
4
6. Elektrofiele substitutiereacties met benzeenderivaten (p. 380 e.v.)
Een benzeenderivaat is een stof bekomen door één of meerdere H-atomen van benzeen te vervangen
(substitueren) door ene ander(e) atoomgroep.
6.1.
Ortho-pararichtende substituenten
De nitrering van fenol is een elektrofiele additie met als nettovergelijking:
NO2
OH
OH
+ 3 H2O
+ 3 HNO3
O2N
NO2
2,4,6 trtinitrofenol
In vergelijking met de nitrering van benzeen merken we op dat de reactie
-
sneller verloopt en dan nog zonder katalysator;
drie H-atomen worden gesubstitueerd;
de H-atomen in orto- en para-positie ten opzichte van de OH worden vervangen.
De bromering van fenol verloopt gelijkaardig:
Br
OH
OH
+ 3 HBr
+ 3 Br2
Br
Br
2,4,6 tribroomfenol
De hydroxylgroep beïnvloedt dus duidelijk de snelheid van de reactie en de oriëntering van de
substituenten, ongeacht de aard van het substituent.
De hydroxylgroep heeft een negatief inductief effect (-I). Het negatief inductief effect verkleint de
elektronendichtheid in de benzeenring, en biedt dus geen verklaring voor de hogere reactiesnelheid en
voor de plaatsing van de substituenten.
De hydroxylgroep heeft naast een negatief inductief effect, een mesomeer effect:
5
H
O
Door dit positief mesomeer effect (+M) verhoogt de elektronendichtheid van de ring, zodat elektrofiele
deeltjes sneller aanvallen in vergelijkig tot benzeen. Bovendien blijkt uit bovenstaande dat de
elektronendichtheid het grootst is rond de C-atomen in ortho- en para-posities ten opzichte van de
hydroxylgroep: op deze plaatsen gaan elektrofiele deeltjes zich hechten. De elektronendichtheid is
bovendien groot genoeg opdat drie H-atomen worden gesubstitueerd, zelfs zonder tussenkomst van
een katalysator.
Alle substituenten die een positief mesomeer effect op de ring uitoefenen, zullen de nieuwe
substituenten in ortho- en para-posities oriënteren. Deze zogenaamde ortho- en pararichtende
substituenten betreffen in de eerste plaats groepen waarvan het atoom dat aan de benzeenring is
gebonden, over een vrij elektronenpaar beschikt.
Groepen met O en N hebben een sterk positief mesomeer effect, dat groter is dan het negatief inductief
effect. Indien de groep negatief geladen is (O-) is het inductief effect positief (+I), en versterkt het
mesomeer effect.
Alkylgroepen hebben een positief inductief effect maar geen mesomeer effect. Ze verhogen de
elektornendichtheid van de ring, in het bijzonder op de ortho- en paraposities.
Halogeenatomen deactiveren de ring: hun negatief inductief effect blijkt groter te zijn dan het positief
mesomeer effect. Het negatief inductief effect maakt een elektrofiele aanval minder gemakkelijk, maar
de desactivatie is het kleinst ter hoogte van de ortho- en para-posities door het mesomeer effect.
O- > -N-, -OH, OR >
6.2.
CnH2n+1 > X
Meta-richtende substituenten
De nettovergelijking van de nitrering van nitrobenzeen is de volgende
6
NO2
NO2
H2SO4
+ H2O
+ HNO3
NO2
m dintriobenzeen
Deze reactie verloopt echter moeilijker dan met benzeen, er wordt steeds één H-atoom gesubstitueerd
en het substituent komt terecht op de meta-positie.
De bromering van nitrobenzeen verloopt gelijkaardig:
NO2
NO2
FeBr3
+ HBr
+ Br2
Br
m-broomnitrobenzeen
De nitrogroep heeft een duidelijk effect op de reactiviteit van de ring en de plaatsing van de
substituenten. Het negatief inductief effect van de nitrogroep (omwille van sterkere EN-waarde van
stikstof in vergelijking tot koolstof) verkleint de elektronendichtheid van de benzeenring, en verklaart
daarmee de lagere reactiviteit.
De nitrogroep oefent ook een negatief mesomeer effect uit op de benzeernring:
O
O
N
O
O
O
N
O
N
O
O
O
N
O
N
7
Het negatief mesomeer effect versterkt het negatief inductief en desactiveert verder de ring. De
elektronendichtheid wordt het minst beïnvloed ter hoogte van de meta-plaatsen, waardoor de
elektrofielen vooral op deze plaatsen komen te zitten.
Alle substituenten met een meervoudige binding en een positieve formele/deellading op het atoom dat
aan de ring gebonden is, hebben een negatief inductief effect én een negatief mesomeer effect. Zij
oriënteren bijgevolg de nieuwe substituenten in de meta-positie.
Net als bij de ortho-para-richters, bestaan ook meta-richters zonder mesomeer effect, zoals
bijvoorbeeld CX3 (vertoont een zeer groot negatief inductief effect) en NH3+.
-CX3, - N+ - < NO2, CN, CO, SO3H
6.3.
Reacties met disubstitutieproducten van benzeen
Als een disubstitutieprodukt van benzeen aan een elektrofiele substitutie onderworpen wordt, bepaalt
de sterkste van de aanwezig substituenten de positie van het elektrofiel:
O- > -N-, -OH, OR >CnH2n+1 > X > -CX3, - N+ - > NO2, CN, CO, SO3H
Voorbeeld: sulfonering van meta-nitrofenol
Voorbeeld: en nitrering van aminofenolaat
(Oefeningen zien boek p. 392)
8
Fenol
Fenol of hyrdoxybenzeen is een aromatisch alcohol.
7. Fysische eigenschappen
Alcoholen zijn oplosbaar in water en polaire oplosmiddelen als de alkylketen relatief kort is. Bij fenol
overheeroverheerst de fenyl-groep, waardoor fenol slecht oplosbaar is in water. Het is een witte vaste
stof.
7.1.
Zure/basische eigenschappen.
Net als alle andere alcoholen, heeft fenol een amfoteer karakter. Het kan zowel als zuur en als base
reageren, afhankelijk van zijn omgeving.
In vergelijking tot een niet-aromatisch alcohol met gelijk aantal koolstofatomen (hexanol), is fenol een
sterker (maar toch zwak) zuur. De benzeenring heeft wel een positief inductief effect, door het
negatieve mesomere effect van de benzeenring wordt het vrijmaken van een proton (H +) bevorderd.
Bij afstand van een proton, ontstaat het fenolaation. De negatieve lading op het zuurstofatoom wordt
bovendien door mesomerie (stabiliserend !) verspreid over de ring. Het zure effect wordt verder
versterkt door bijkomende stabiliserende groepen.
9
Benzoëzuur
1. Inleiding
Benzoëzuur of benzeencarbonzuur is een aromatisch carbonzuur.
1.1.
Zure eigenschappen
Benzoëzuur is een carbonzuur en sterker dan alcoholen/fenol. De carbonylgroep oefent een negatief inductief
effect uit op de –OH groep, waardoor sneller een proton wordt afgesplitst.
Bovendien heeft de carbonylgroep ook een negatief mesomeer effect op de –OH groep, én worden de
elektronen ook betrokken met de mesomere elektronen van de ringstructuur.
De negatieve lading van het carboxylaation, wordt ook gestabiliseerd door mesomerie.
Benzoëzuur is om hogere redenen een sterker zuur dan fenol. Omdat de elektronen ook betrokken worden in de
mesomere binding van de benzeenring, is benzoëzuur een sterker zuur dan het niet-aromatisch carbonzuur
(hexaanzuur) met evenveel C-atomen.
1.2.
Andere chemische eigenschappen
1.2.1. Oplosbaarheid
Benzoëzuur is weinig oplosbaar in water. Het is een witte vaste stof.
10
Belang van benzeen en benzeenderivaten
Het moet duidelijk zijn uit bovengenoemde (deel)hoofdstukken dat benzeen en benzeenderivaten een
belangrijke rol spelen in de maatschappij. Benzeen zelf is bijzonder toxisch en bij contact met de huid kan het
aanleiding geven tot aantasting van het beenmerg. Een aantal toepassingen worden kort toegelicht.
1. Insecticide
DDT of dichloordifenyltrichlooretheen (zie eerder) is een insecticide die in het verleden veel werd gebruikt. Het
interfereert met Na+-K+-pomp van zenuwcellen bij insecten. De insecten sterven dus door verlamming. DDT is
biologisch zeer moeilijk afbreekbaar en bio-accumuleert in de voedselpiramide.
2. Agent Orange
Agent Orange is een veel gebruikt ontbladeringsmiddel tijdens de oorlog in Viëtnam. Het is een combinatie van
twee arenen. Het heeft echter een nefaste invloed op de ontwikkeling. Heel wat kinderen verwekt na de oorlog in
Viëtnam door oudstrijders en Viëtnamezen, vertoonden ernstige lichamelijke afwijkingen.
3. Aspirine
Aspirine is een pijnstiller met een koortswerende werking. Het werd in het verleden vooral gebruikt als pijnstiller.
Aspirine heeft echter een bloedverdunnende werking en inname zonder doktersvoorschrift kan gevaarlijk zijn.
Aspirine of acetylsalicylzuur (links) is afgeleid van salicylzuur (rechts)
Bereiding van aspirine
11
Salicylzuur verestert met azijnzuur tot aspirine:
4. Vanille
Vanille is een voedseladditief. Het is vrij duur en wordt gewonnen uit een orchidee.
5. Synthetische wasmiddelen
Zepen hebben als nadeel dat ze in hard water neerslaan. Detergenten zijn synthetische wasmiddelen die in hard
water oplosbaar blijven. De meeste synthetische wasmiddelen zijn alkylbeneensulfonaten.
12












