DEEL 3 KERNENERGIE
1 Structuur van de atoomkern
1.1 Quarks en leptonen
4
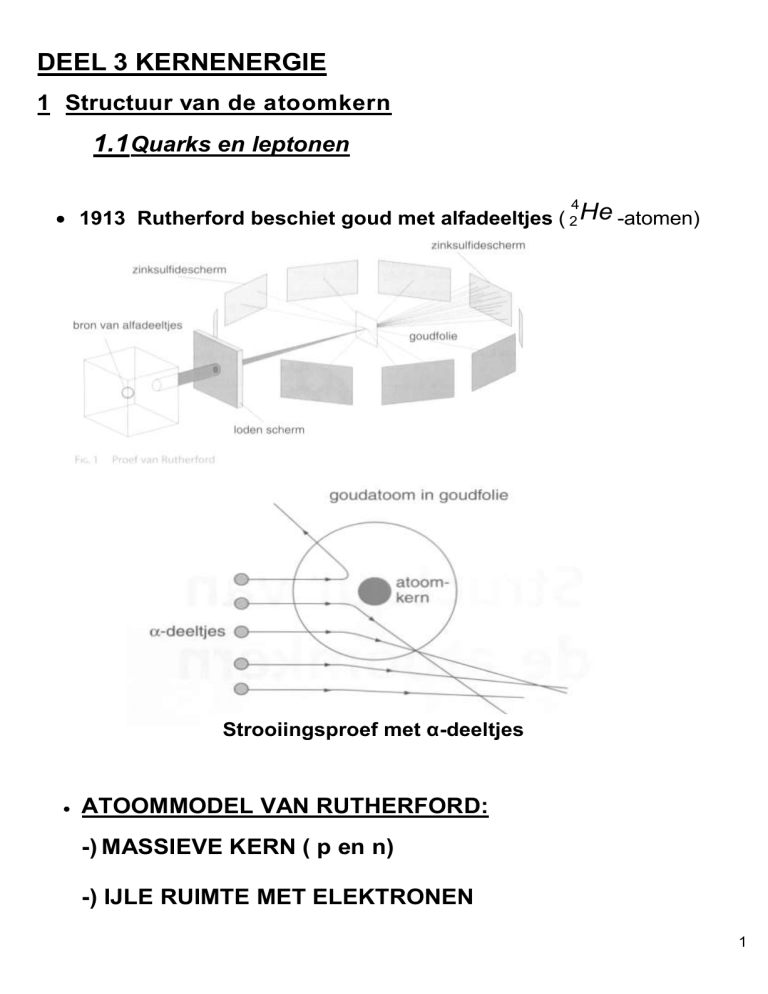
1913 Rutherford beschiet goud met alfadeeltjes ( 2 He -atomen)
Strooiingsproef met α-deeltjes
ATOOMMODEL VAN RUTHERFORD:
-) MASSIEVE KERN ( p en n)
-) IJLE RUIMTE MET ELEKTRONEN
1
20ste eeuw: Men schiet elektronen op protonen: I
1964 Gell-Mann en Zweig:het quarkmodel
Proton
Electronen
hoge snelheid
Quark q
Voorbeelden:
-) proton p: up, up en down quark (u,u,d) (lading?)
-) neutron n: up, down en down quark (u,d,d)
2
GROTE VERSNELLERS (VB. CERN)
-) Energie wordt omgezet in materie
-) Ontdekking bouwstenen v. d. natuur
BOUWSTENEN VAN DE NATUUR
Baryonen :
3 quarks
Hadronen: quarks
en /of antiquarks
Alle vanuit
energie
gevormde
deeltjes
Mesonen:
quark en
anti-quark
Leptonen: niet
samengestelde
deeltjes
QUARKS en LEPTONEN
3
1.2 De vier fundamentele wisselwerkingen
1.2.1 Gravitationele wisselwerking
Houd het heelal bij elkaar
Boodschapper: Gravitonen
1.2.2 Elektromagnetische wisselwerking
Elektrische kracht
Magnetische kracht
Chemische bindingen
Houd kern en e- bij elkaar
Boodschapper: Fotonen
4
1.2.3
Sterke wisselwerking
Wisselwerking tussen quarks
Houd kern bij elkaar
proton
neutron
Boodschapper: Gluonen
1.2.4
Zwakke wisselwerking
Verandert de aard van deeltjes.
Veroorzaakt radioactiviteit
Vb.. down-quark verandert in up-quark, elektron antineutrino.
5
1.3 Atoomnummer, massagetal en nucleïde
Atoomnummer Z:
-) aantal protonen
-) bepaalt atoomsoort
Massagetal A:
-) Aantal kerndeeltjes: protonen + neutronen
Nucleonen: de kerndeeltjes
massagetal = nucleonengetal.
notatie:
Massagetal A
197
79
Au
Soortnaam
Atoomnummer Z
-) Aantal neutronen A – Z : hier 197 – 79 = 118
-) Algemeen:
A
Z
X
6
Nucleïde:
atoomkern met bepaald protonental én welbepaald
neutronental
Opmerking:
-) symbool nuclide = chemich symbool
12
-) 6
-nuclide: kern met 6 protonen en 6
neutronen.
C
12
-) 6
C
-atoom: 6 protonen, 6 neutronen en 6
elektronen.
-) nucleïde: enkel de kern van het atoom
1.4 Isotopen en isotope nucleïden
Isotopen:
atomen met zelfde aantal protonen, verschillend aantal
neutronen. (zelfde atoomsoort)
Isotope nucleïden atoomkernen met zelfde protonental,
verschillend neutronental.
-) Voorbeeld: isotope nucleïden
1
1
H
2
1
H
1
1
H
2
, 1
3
1
H
en
3
1
H
H
7
1.5 STABILITEIT VAN EEN ATOOMKERN
tabel met enkele stabiele chemische elementen
Chemisch
Element
Waterstof H
Helium He
Lithium Li
aluminium
Al
Ijzer Fe
Jood I
Goud Au
Lood Pb
Uraan U
atoomnummer of
protonental Z
1
2
3
13
26
53
79
82
92
massagetal A neutronental
1
4
7
27
0
2
4
14
56
127
197
208
238
30
74
118
126
146
-) zwaardere stabiele atoomkernen: gaandeweg meer
neutronen dan protonen in de kern
-) Stabiliteitsband.
8
Verklaring:
afstotende elektrische kracht:
tussen protonen is groot
-) reikwijdte is groot
aantrekkende kracht:
-) sterke wisselwerking tussen de quarks
-) reikwijdte is klein.
Bij vele protonen: ze beïnvloeden elkaar allemaal (?)
Dus vele neutronen zijn nodig als bindmiddel
9
1.6 ATOMAIRE EENHEDEN VOOR MASSA EN ENERGIE
1.6.1 Atomaire massa-eenheid
WAAROM?
Definitie:
massa 126C
-27
1u=
=
1,660510
kg
12
gevolg: 1 kg= 6,022 3 .1026 u
1.6.2 Elektronvolt
In kerfysica; energie-eenheid is Elektronvolt (1eV)
DEFINITIE:
Een elektronvolt: kinetische energie die een lading e =
1,6022 .10 19C verkrijgt als deze een spanning van 1
Volt doorloopt.
Dus:
1 eV = 1,6022. 10 19 Joule
Kernfysica: MeV
GeV
10












