MOLECULAIRE GENETICA door
De auteur stelt zich niet aansprakelijk voor eventuele fouten op het gebied van inhoud, spelling of wat voor fouten dan ook.
VEENING
DNA
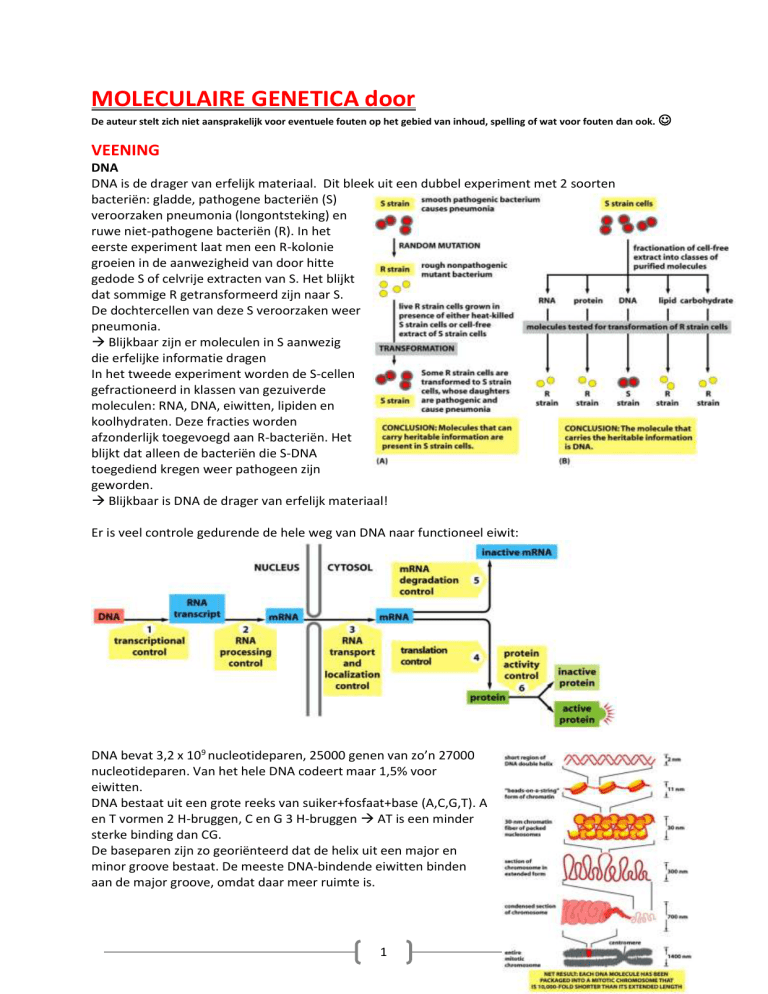
DNA is de drager van erfelijk materiaal. Dit bleek uit een dubbel experiment met 2 soorten
bacteriën: gladde, pathogene bacteriën (S)
veroorzaken pneumonia (longontsteking) en
ruwe niet-pathogene bacteriën (R). In het
eerste experiment laat men een R-kolonie
groeien in de aanwezigheid van door hitte
gedode S of celvrije extracten van S. Het blijkt
dat sommige R getransformeerd zijn naar S.
De dochtercellen van deze S veroorzaken weer
pneumonia.
Blijkbaar zijn er moleculen in S aanwezig
die erfelijke informatie dragen
In het tweede experiment worden de S-cellen
gefractioneerd in klassen van gezuiverde
moleculen: RNA, DNA, eiwitten, lipiden en
koolhydraten. Deze fracties worden
afzonderlijk toegevoegd aan R-bacteriën. Het
blijkt dat alleen de bacteriën die S-DNA
toegediend kregen weer pathogeen zijn
geworden.
Blijkbaar is DNA de drager van erfelijk materiaal!
Er is veel controle gedurende de hele weg van DNA naar functioneel eiwit:
DNA bevat 3,2 x 109 nucleotideparen, 25000 genen van zo’n 27000
nucleotideparen. Van het hele DNA codeert maar 1,5% voor
eiwitten.
DNA bestaat uit een grote reeks van suiker+fosfaat+base (A,C,G,T). A
en T vormen 2 H-bruggen, C en G 3 H-bruggen AT is een minder
sterke binding dan CG.
De baseparen zijn zo georiënteerd dat de helix uit een major en
minor groove bestaat. De meeste DNA-bindende eiwitten binden
aan de major groove, omdat daar meer ruimte is.
1
FISH: Fluorescent in situ Hybridisation is bedoeld voor het op kleine schaal lokaliseren van loci. Dit
gebeurt door een probe (bestaande uit complementair RNA en fluorochromen) toe te voegen aan
het DNA waar men geïnteresseerd in is.
Condensatie
Het DNA uit een eukaryote cel is zo’n 2 meter lang. Dit moet zich allemaal bevinden in een celkern
van zo’n 10 µm. Daarom is het DNA in chromosomen erg gecondenseerd.
Die condensatie begint bij histonen, bestaande uit een helix-turn-helix motief. Dit zorgt ervoor dat
histonen makkelijk een dimeer kunnen vormen. Een octameer (4 dimeren) vormt samen met het
DNA een nucleosoom. Het totale complex (DNA+DNA-bindende eiwitten) wordt chromatine
genoemd. Histonen zijn, vanwege een grote hoeveelheid lysine en arginine, positief geladen.
Histonen binden aspecifiek aan het negatief geladen DNA
Nucleosomen zijn dynamisch: in elke 300 ms is een nucleosoom 50 ms unwrapped. Dit biedt de kans
voor de binding van een sequentiespecifiek DNA-bindend eiwit. Deze dynamiek is nog onvoldoende
voor transcriptie. Daarom zijn er aanvullende complexen nodig, bijv. nucleosoom sliding. Dit vereist
een ATP-afhankelijke chromatin remodeling complex. Door hydrolyse van ATP kan het DNA over het
nucleosoom ‘heen worden getrokken’. Dit complex is ook nodig voor nucleosoom removal en
remodeling, waarbij delen van histonen of zelfs het hele octameer kunnen worden vervangen.
Naast elkaar gelegen nucleosomen zijn verbonden via linker DNA, gebonden door het linker histon
H1.
Er zijn 3 DNA-sequenties nodig voor replicatie en segregatie: telomeer, origin of replication
complexes (ORC’s) en centromeer. ORC’s zijn vaak AT-rijke sequenties, dit bevordert het
‘openmaken’ van de dubbele helix.
Aan het centromeer kunnen condensins, die SMC (Structural Maintenance of Chromosomes)
bevatten, binden. SMC is belangrijk voor chromosoomsegregatie in bacteriën, maar deze
chromosoomsegregatie verloopt nog beter met parB-eiwitten. Bij ORC’s bevinden zich zgn. parS-sites
waarbij parB kan accumuleren. ParB recruteert vervolgens SMC-eiwitten naar de parS-sites. Deze
interactie draagt bij een chromosoomsegregatie. ParB/SMC draagt actief bij aan
chromosoomsegregatie. Andere bijdragende processen zijn passief: DNA-replicatie, entropische
‘demixing’ (thermodynamisch voordeel om uit elkaar te gaan), transertie (gekoppelde transcriptie en
translatie zorgt voor kracht van DNA naar membraan), transcriptie (RNA zorgt voor
chromosoomsegregatie stimulerende energie) en supercoiling/decatenatie (het uit elkaar halen van
de dubbele ringen na replicatie).
2
Kloneren
Bij kloneren is er sprake van kernoverdracht (nuclear transfer).
Beroemd is de klonering van Dolly: Moeder 1 levert een
somatische cel die men laat fuseren met een eicel van moeder 2
waaruit de nucleus is gehaald. De gefuseerde cel laat men groeien
in een cultuur en het vroege embryo plaatst men dan in moeder 3
waaruit het lam vervolgens ‘geboren’ wordt. Dolly heeft het
chromosomaal DNA van 1 en het mitochondrieel DNA van 2.
Therapeutisch kloneren is ook mogelijk: in plaats van dat men het
embryo in een moeder plaatst, laat men het groeien in de
aanwezigheid van bepaalde stoffen, zodat er gedifferentieerde
cellen ontstaan.
Problemen van nuclear transfer zijn: het large offspring syndrome,
incomplete nucleaire reprogrammering, afwijkende DNAmethylatie en imprintingproblemen.
Epigenetica
Epigenetica betreft de vormen van erfelijkheid die niet vastliggen
in de basenvolgorde van het DNA. Epigenetica kan erfelijk zijn, dit
is niet altijd het geval. Een voorbeeld van epigenetica is de lapjeskat (altijd vrouwtjes). Bij vrouwelijke
zoogdieren vindt X-chromosoominactivatie plaats. Dit compenseert het verschil met de man (per
definitie slechts 1 X-chromosoom). De vachtkleur ligt bij katten op het X-chromosoom. Welk Xchromosoom er op een bepaalde plaats actief is bepaalt dus de vachtkleur. Bovendien geldt: hoe
groter de lapjes, des te eerder heeft X-chromosoominactivatie plaatsgevonden.
Een ander voorbeeld van epigenetica is het verschil tussen eeneiige tweelingen die steeds
verschillender worden.
Moleculaire basis van epigenetica
Er zijn drie mogelijkheden om epigenetisch de genexpressie te regelen
- Modificatie van histonstaarten
Histonstaarten kunnen worden gemodificeerd door acetylatie, methylatie, fosforylatie en
ubiquitylatie (waarbij er een grote peptide aan wordt gezet). Deze modificaties zorgen samen
voor een histoncode en een specifieke binding-site van de histonstaart. Hieraan kunnen
eiwitten binden die reader-complexes genoemd worden. Aan dit complex kunnen dan weer
eiwitten binden die tot genexpressie of gensilencing leiden. De histoncode kan door het
chromatine worden verspreid door middel van reader-writer-complexes. Uiteindelijk zorgen
de modificaties samen met genactivatoreiwitten voor transcriptie-initiatie.
- DNA-methylatie
DNA-methylatie wordt veel gebruikt om genen uit te schakelen en kan ook worden
overgeërfd. Methylatie kan uitsluitend plaatsvinden op een cytosine naast een guanine. Er
wordt dan 5-methylcytosine gevormd. Maintenance methylase zorgt ervoor dat na replicatie
de C (complementair aan de G) ook gemethyleerd wordt.
- miRNA/siRNA
Deze small RNA’s hebben een rol bij post-transcriptionele regulatie in de vorm van RNAstabiliteit en translatie.
Zo wordt bij oxidatieve stress de translatie onderdrukt doordat de ribosome binding-site
(Shine Dalgarno) niet wordt herkend, en bij lage temperatuur wordt de translatie juist
geactiveerd. Bij een laag ijzergehalte wordt mRNA gedegradeerd en bij stress wordt het
mRNA juist beschermd. Deze sRNA’s komen zowel in pro- als in eukaryoten voor. Chaperone
Hfq speelt een grote rol in de sRNA-regulatie.
3
Veranderingen in DNA (rearrangements)
DNA-rearrangements worden veroorzaakt door recombinatie of transposable elements
DNA-rearrangement kan combinatie van genen en de mate en timing van expressie beïnvloeden, en
zo kan een organisme evolueren in reactie op een veranderend milieu.
Genetische recombinatie kan op twee manieren:
- General (homologous) recombinatie
Genetische uitwisseling tussen twee homologe
(overeenkomstige nucleotidenvolgorde) DNAsequenties. Meestal liggen die sequenties op eenzelfde
chromosoom.
Deze recombinatie wordt gebruikt voor
hersteloperaties bij fouten in DNA-replicatie. Verder is
deze recombinatie essentieel bij de meiose (waarbij 2
homologe DNA-moleculen elkaar kruisen). Bij
recombinatie worden er zgn. sticky ends gevormd (door
exonucleaseactiviteit die een single-strand 3’ end
blootlegt. De vrije 3’OH eindjes zoeken vervolgens een
homologe DNA-helix om te baseparen). Deze sticky
ends zorgen ervoor dat na recombinatie er basen zijn
die met basen van een verschillende helix hebben
gepaard. Die basen vormen samen het heteroduplex
joint, dat duizenden basenparen groot kan zijn. Aan
weerszijden van de heteroduplex joint is de nucleotiden
volgorde vaak niet exact hetzelfde. Op zo’n manier
wordt DNA-informatie op nieuwe manier gerangschikt.
Voor recombinatie is altijd een breuk in het DNA noodzakelijk.
Mechanisme: breuk in DNA strand invasion (van ES 3’ uiteinde in DS) produceert D-Loop
Holliday Junction 2 oplossingen door horizontaal of verticaal knippen Ligatie
De manier van knippen bepaalt of er wel of geen cross-over plaatsvindt. Tijdens mitose
wordt cross-over zoveel mogelijk gemeden, terwijl bij meiose meer cross-over plaatsvindt en
er dus meer variatie ontstaat.
De twee strengen die gaan paren moeten in ongevouwen toestand zijn. Hiervoor wordt het
essentiële single-strand DNA-binding protein (SSB) gebruikt. Dit eiwit bindt sterk en
coöperatief aan de suiker-fosfaatbackbone en zorgt ervoor dat de baseparen (in de major
groove) naar buiten steken voor effectieve hybridisatie. Verder is RecA van belang, dit zorgt
ervoor dat het ES kan invaseren in DS door het scannen van de naar buiten stekende
baseparen. Bovendien kan RecA ES- en DS-DNA bij elkaar houden. Via trial-and-error volgt
herkenning van homologe gebieden en treedt branch migration op. RecA zorgt er ook nog
voor dat deze branch migration unidirectioneel is door hydrolyse van ATP. Vanwege deze
diversiteit aan functies van RecA is dit eiwit erg geconserveerd in de evolutie.
Gene conversion
Doordat er bij homologe recombinatie
vaak geen volledige homologie is, ontstaan
er vaak bij DNA-replicatie verschillende
chromosomen. In andere gevallen is er
eerst mismatch repair dat 1 van de
strengen van de heteroduplex joint
verwijdert. DNA-synthese vult vervolgens
het gemaakte gat op, maar creëert daarbij
automatisch een extra kopie van een gen.
Na replicatie is bevatten beide
4
chromosomen hetzelfde gen. Dit wordt gene conversion genoemd.
Ondanks dat er veel homologe sequenties voorkomen in het genoom, treedt er relatief
weinig recombinatie op. Dit is te danken aan mismatch proofreading dat recombinatie
onderbreekt bij te veel afwijkingen.
-
Site-specifieke recombinatie (SSR)
Een verschil met homologe recombinatie is dat site-specifieke recombinatie wél de
genvolgorde verandert (terwijl bij homologe recombinatie slechts allelen uitgewisseld
kunnen worden) Verder kan SSR informatie aan het genoom toevoegen door mobiele
elementen te verplaatsen. Op deze manier is SSR verantwoordelijk voor de meeste
evolutionaire veranderingen in het genoom. SSR wordt onderverdeeld in transpositional SSR
en conservative SSR.
Transpositional SSR (TSSR)
Verloopt via DS-breuken en vervolgens aanhechting van de uiteinden aan niet-homologe
target sites, waarbij geen heteroduplex wordt gevormd. Omdat de aanhechting niet
homoloog verloopt, kan TSSR op veel verschillende plaatsen in het genoom voorkomen. Van
TSSR bestaan weer drie klassen:
o DNA-only transposons werken m.b.v. cut-and-paste transpositie. De DS-breuk kan
worden hersteld door zowel homologe als niet-homologe end-joining.
o Retroviral-like retrotransposons werken met behulp van reverse transcriptase: Na
transcriptie van gastheer-DNA ontstaat retroviral-like RNA dat codeert voor reverse
transcriptase. Dit eiwit kan weer DS R-like DNA vormen wat geïntegreerd kan worden
in een chromosoom
o Non-retroviral retrotransposons, bijvoorbeeld Line, werken met gekoppelde reverse
transcriptase en integratie (dus wezenlijk anders dan bij retrovirussen).
In bacteriën komen DNA-only transposable elements het meeste voor, in gisten retrovirallike transposons en in mensen alle drie de typen.
Conservative SSR (CSSR)
Voor CSSR is een korte homologe sequentie nodig in de donor en het recipiënte DNA. Er
wordt een korte heteroduplex gevormd.
CSSR wordt uitgevoerd door knip-en-plakreacties op 2 verschillende DNA-moleculen.
Afhankelijk van de oriëntatie van de recombinatie sites is het resultaat: integratie, excisie of
inversie. Al deze reacties zijn reversibel.
CSSR wordt in transgene dieren gebruikt om genexpressie te bestuderen.
5
Bacteriofaag lambda
Bacteriofagen prolifereren door middel
van twee pathways: de prophage en de
lytische pathway.
Bij de prophage pathway integreert het
lambda-DNA in het chromosoom van de
host. Vervolgens repliceert dat DNA bij
elke celdeling. Bij de lytische pathway
integreert het lambda DNA niet in het
DNA van de host cell, maar wordt uit het
lambda-DNA virale eiwitten
gesynthetiseerd voor de formatie van
nieuwe eiwitten. In de cel ontstaan op
deze manier meerdere virussen die na
cellysis kunnen verspreiden.
De prophage pathway kan op ieder
moment overgaan in de lytische.
ChIP-on-chip
ChIP-on-chip kan worden gebruikt als je
wilt weten of een gegeven eiwit bindt
aan een bepaalde DNA-sequentie, als je
de eiwitbinding in verschillende staten
van DNA onderzoekt, of geïnteresseerd
bent in specifieke genen.
Het belangrijkste kenmerk van Chromatin Immuno Precipitation is het gebruik van antibodies die een
bepaald eiwit kunnen herkennen. Die antibodies kunnen dat eiwit zowel herkennen in een oplossing
6
met vrij DNA als in compact chromatine. De techniek is als volgt: DNA-bindende eiwitten worden
gecrosslinked aan DNA met formaldehyde. Vervolgens wordt het chromatine geïsoleerd en het DNA
gefragmenteerd. Dan worden er antibodies toegevoegd die specifiek aan een eiwit kunnen binden.
Dat complex wordt gescheiden en vervolgens geamplificeerd met behulp van PCR.
Een soortgelijke methode als ChIP-chip is ChIP-seq. Deze methode geeft een resolutie van een enkel
nucleotidenpaar. Het grootste verschil tussen beide methoden is dat men bij ChIP-chip fluorescerend
materiaal toevoegt wat men later analyseert op een chip, en dat men bij ChIP-seq de hele
nucleotidenvolgorde sequencet. Bij ChIP-seq is veel minder DNA vereist, maar de techniek is wel een
stuk duurder. Bij beide methoden is bioinformatica vereist om de data goed te kunnen analyseren.
KUIPERS
DNA-bindende eiwitten
Eiwitten kunnen binden aan DNA. Dit gebeurt voornamelijk in de major groove. Doel hiervan is
uiteindelijk genregulatie. Zo zijn er eiwitten die het DNA kunnen buigen (CAP). Helix-turn-helix (HTH)
is een veel voorkomend DNA-bindend eiwit. Andere belangrijke eiwitten zijn Helix-loop-helix (HLH),
homeodomeinen (DNA-bindende
domeinen die genregulatoreiwitten
omschrijven die belangrijk zijn voor
dierlijke ontwikkeling) en zinkvingers
(vaak aanwezig in tandem clusters
waarvan de verschillende α-helices
aan de major groove kunnen binden,
en zo een DNA-eiwit-interactie
opgebouwd kan worden).
Voor onderzoek is het vaak nodig om
het DNA-bindende eiwit te isoleren.
DNA-affiniteitschromatografie is daar
een goede techniek voor, mits men de
specifieke DNA-sequentie kent.
Het principe achter deze techniek is
kolomchromatografie. Eerst bevat de
kolom random DNA waardoor
eiwitten geleid worden. Na een lowsalt wash elueren de eiwitten die niet
aan DNA kunnen binden. Na een medium-salt wash elueren de DNA-bindende eiwitten. In de
volgende stap neemt men een kolom met de specifieke DNA-sequentie, waardoor men de DNAbindende eiwitten leidt. Na de medium-salt wash elueren de eiwitten die niet kunnen binden aan de
specifieke sequentie en met de high-salt wash kan men zo de de specifieke DNA-bindende eiwitten
isoleren.
Genregulatie
Het trp-operon is een belangrijk voorbeeld van genregulatie in bacteriën. Als er geen tryptofaan in
het medium is staat het operon aan en worden de genen benodigd voor tryptofaansynthese
afgeschreven. Zodra er wel tryptofaan in het medium is, wordt dat opgenomen en bindt het
tryptofaan vervolgens aan een inactieve repressor, dat hiermee een actieve repressor wordt en
daarmee het operon uitschakelt. Dit is vorm 1a (zie volgende alinea).
Er zijn 4 manieren van genregulatie. Er wordt onderscheid gemaakt tussen negatieve (waarbij een
gebonden repressor transcriptie verhindert, 1) en positieve genregulatie (waarbij een gebonden
activator transcriptie promoot, 2). Bij beide manieren kan additie van een ligand het regulatoreiwit
verwijderen (a) of zorgt verlies van een ligand juist voor verwijdering van het regulatoreiwit (b).
7
Soms kunnen regulatoreiwitten zowel activator
als repressor zijn, afhankelijk van de plaats op
het DNA waar het eiwit bindt. Dit is het geval bij
de lambda repressor. Vaak is er meervoudige
controle op een operon. Dit is het geval bij het
lac operon. Alleen als er geen glucose is en juist
wel lactose wil de cel enzymen maken voor de
afbraak van lactose. CAP is een activator, dit
bindt alleen als er geen glucose is (2b). Verder is
er een repressor dat gebonden is als er geen
lactose aanwezig is (1a).
Pathogeniciteit
Als je de indeling van het leven bekijkt valt op
dat pathogenen zowel bij bacteriën als bij
eukaryoten voorkomt, maar niet bij archaea.
Dit komt omdat archaea extremofielen zijn. Deze extreme omstandigheden zijn er niet bij bacteriën
en eukaryoten.
De indeling van bacteriën gaat verder in grampositieve of –negatieve bacteriën. Grampositieve
bacteriën bevatten alleen een binnenmembraan en een enorme peptidoglycaanlaag. Antibiotica
werken alleen op grampositieve bacteriën. Gramnegatieve bacteriën hebben zowel een binnen- als
een buitenmembraan en daartussen bevindt zich een kleine peptidoglycaanlaag.
De meeste pathogenen zijn cocci (bolvormig) of bacilli (staafvormig).
Kenmerkend voor een aantal pathogenen is een
complexe levenscyclus. Malaria is hier een
voorbeeld van. Gameten worden in het bloed van
de mens gevormd, en de zygote in de darm van de
mug. Door muggensteken worden de cellen
overgebracht van mug naar mens en vice versa.
Een ander voorbeeld is pathogeen Yersinia pestis.
Deze veroorzaakt in vlooien een verstopping
waardoor de vlo vaker en langer bloed gaat zuigen.
Op deze manier heeft de pathogeen meer kans om
overgedragen te worden.
Een pathogeen moet dus altijd zorgen in de host
cell te komen. E. coli heeft een systeem bedacht
dat voor betere aanhechting zorgt: Als E. Coli aan
een eukaryoot hecht, injecteert hij met het type-III-secretiesysteem het eiwit Tir. In de cel vormt dat
eiwit een receptor dat naar het membraan getransporteerd wordt. Aan die receptor kan intimine
binden die zich al op de membraan van E. coli bevindt. Op deze manier wordt dus betere
aanhechting gerealiseerd.
Een andere complicatie voor een pathogeen is het moeten verbergen voor het immuunsysteem. Dat
kan bijvoorbeeld door zich in een macrofaag te nestelen of door het ombinden van het ER
(legionella).
Na aanhechting scheiden de bacteriofagen vaak Ca2+-signalen uit, die daarmee lysosomen recruteren.
Die lysosomen bieden voorlopig bescherming tegen het immuunsysteem. Eenmaal in de cel beland
kiest de pathogeen of hij direct ontsnapt en repliceert, door secretie van porievormend eiwit, of dat
hij fuseert met andere lysosomen om een groot phagolysosoom te vormen.
Listeria komt op een overeenkomstige manier in de cel terecht. Maar eenmaal in de cel vindt
actinenucleatie plaats met actinegebaseerde bewegingen als gevolg. Op deze manier komt Listeria bij
de celmembraan terecht en kan hij naar de andere cel gaan als er ‘toevallig’ fagocytose optreedt. In
deze cel begint het verhaal opnieuw.
8
LINSKENS
DNA-replicatie
Tijdens DNA-replicatie worden nieuwe
baseparen gevormd. Daartoe zijn veel
enzymen/eiwitten nodig: Helicase om het
DNA te ontwinden, SS-DNA-binding
proteins om de enkele streng vast te
houden, DNA-primase om een primertje te
maken waaraan vervolgens DNApolymerase kan hechten dat dan kan gaan
polymeriseren. De replicatie is bidirectioneel: er worden dus twee replicatievorken gevormd. Verder
is er sprake van semi conservatieve replicatie: Na replicatie bevatten beide dubbele strengen één
streng die al bestond en één aangemaakte streng.
DNA-polymerase kan maar één kant op werken: van 5’ naar 3’. Dit impliceert een leading, waarin
DNA-polymerase in één keer door kan, en een lagging strand, waarin DNA-polymerase steeds kleine
stukjes polymeriseert. Dit vereist ruimte voor een zgn. Okasakifragment. Deze ruimte is er niet aan
het eind van een chromosoom. Dit wordt het eindreplicatieprobleem genoemd. Dit probleem wordt
opgelost met telomerase. Dit eiwit maakt met behulp van een template en reverse transcriptase die
hij ‘zelf meeneemt’ het 3’-eind langer, waardoor er toch een Okasakifragment kan worden gevormd.
Tijdens replicatie worden fouten gemaakt: gemiddeld één fout per 100.000 nucleotiden. Dit zou
betekenen dat bij elke celdeling 10.000 fouten ontstaan. Dit zou niet met het leven verenigbaar zijn.
Daarom zijn er mechanismen om de fouten er zoveel mogelijk uit te halen. Tijdens replicatie gebeurt
dit door proofreading, na replicatie door mismatch repair, en voor mutaties bestaan reparatieenzymen.
Proofreading
Onmiddellijk na DNA-polymeraseactiviteit is een exonuclease ‘aan de beurt’. Deze knipt nucleotiden
die niet goed zijn ingebouwd. Verkeerde nucleotiden hebben zo een grotere kans om door
exonuclease gepakt te worden. Proofreading lost 99 op de 100 fouten op.
Mismatch repair
Mismatch repair gebeurt na replicatie, en dus voortdurend tot de volgende celdeling. Verschillen
tussen baseparen worden verwijderd. Maar dan moet wel herkenbaar zijn welke strand de
oorspronkelijke strand was. Dit kan door verschil in methylering of door nicks, maar die zijn uiteraard
alleen maar in de lagging strand aanwezig (de leading gaat in een vloeiende beweging, zonder nicks).
Mismatch repair lost 99 op de 100 fouten op.
Op deze manier wordt het aantal fouten van 105 naar 105 x 102 x 102 = 109 gebracht.
DNA-schade
Er zijn verschillende mogelijkheden waarop DNA schade kan oplopen: oxidatieve schade,
methylatering, hydrolyse (zoals depurinatie en deaminatie) en schade veroorzakende stoffen, zoals
aflatoxine en vrije radicalen.
Deanimatie van adenine geeft hypoxanthine, en van guanine geeft xanthine. Dit maakt echter weinig
uit, omdat deze basen niet herkend worden en dus niet ingebouwd kunnen worden. Deanimatie van
thymine is niet mogelijk. Echter deanimatie van cytosine geeft uracil. Dit is in principe nog niet
schadelijk omdat uracil niet voorkomt in het DNA (in plaats daarvan thymine), maar het betekent wel
dat deanimatie van gemethyleerde cytosine – 5-methylcytosine – thymine geeft. Dit levert dus wél
een puntmutatie op. Verder heeft UV-licht nog een schadelijke invloed door thymines binnen één
strand te crosslinken.
9
Deze puntmutaties hoeven geen effect te hebben (silent mutation). Er zijn namelijk meer mogelijke
codons dan eiwitten. Er kan ook een ander aminozuur getransleerd worden (missense mutation) en
tenslotte kan er een stopcodon worden geïntroduceerd (nonsense mutation).
Ook kunnen er frameshifts optreden of zelfs hele aminozuren worden toegevoegd of verwijderd.
Met de Ames-test kan mutageniteit worden
onderzocht. Men neemt een mogelijke
mutageen en mixt dat met een
histidineafhankelijke bacteriecultuur (vaak
Salmonella). Dit laat men incuberen op
medium zonder histidine. De bacteriën
gaan dan in principe dood, tenzij de te
onderzoeken stof mutageen is. Dan
bevordert het namelijk het muteren van de
bacteriën. Als blijkt dat na incubatie er veel
kolonies van bacteriën zijn was de stof
mutageen.
DNA-repair
Dat maar liefst 2-5% van alle genen voor DNA-repaireiwitten coderen onderstreept het belang van
deze eiwitten.
De al besproken mismatch repair is hier een voorbeeld van (blz. 9) (2 in onderstaande afbeelding).
Een ander DNA-repairmechanisme is base excision repair (5). Specifieke glycosylases herkennen
veranderde basen en vervolgens verwijderen AP(A-purinische/pyrimidinische)-endonucleasen de
suiker-fosfaatbackbone. Daarna vult DNA-polymerase het gat en maakt ligase het dicht. Glycosylases
herkennen de basen door elke base stuk voor stuk uit de structuur te lichten en te kijken of het de
goede base is.
Een derde mechanisme is nucleotide excision repair (3). Hierbij herkent een enzymcomplex grote
afwijkingen in de helix,
waarna excinucleasen aan
beide kanten in de
backbone knippen en
helicase het fragment met
daarin de fout kan
verwijderen. Vervolgens
maken DNA-polymerase en
ligase het werk af.
Het laatste besproken
repairmechanisme is
dubbelstrengs breukrepair
(4). Na een dubbele breuk
kunnen er 2 dingen
gebeuren: de gebroken
strengen worden weer aan
elkaar geligeerd (nonhomologous end-joining),
hierbij zijn wel enige
nucleotiden verloren
gegaan, of er wordt via
homologe recombinatie
eenzelfde stuk ingebouwd.
Dit levert de originele
10
sequentie weer op (homologous end-joining).
Vrije radicalen
Vrije radicalen (ROS) zijn moleculen of atomen die een ongepaard elektron bevatten in een orbitaal.
Vrije radicalen zoeken naar een ander elektron om gestabiliseerd te worden en zijn daarom erg
reactief. In het lichaam komen vrije radicalen vrij uit de mitochondriële ‘ademhaling’ en uit
cytosolische oxidoreductases (fysiologische signaalmoleculen). Bij hoge concentraties zorgen vrije
radicalen voor schade aan DNA, eiwitten en lipiden. Toch zijn vrije radicalen nodig bij fysiologische en
signaaltransductieprocessen.
Zoals gezegd komen er uit de
mitochondriële ademhaling vrije
radicalen vrij. De ubiquinone, die
essentieel is in de
elektronentransportketen, is daar
verantwoordelijk voor.
In normale omstandigheden is de
hoeveelheid vrije radicalen die uit de
ubiquinone vrijkomt goed op te
vangen. Maar als bijvoorbeeld GS
(glycogen synthetase) niet goed
functioneert zorgt dat voor een
verhoogde glucoseconcentratie. Dat
leidt tot een verhoogd transport van
elektronen en daarmee een verhoogde hoeveelheid ROS.
Bescherming tegen ROS
De cel is in staat om radicalen onschadelijk te maken. Belangrijke enzymen daarvoor zijn Superoxide
dismutase en catalase. Superoxide dismutase komt bijna overal in de cel voor en catalase specifiek in
de peroxisomen. Superoxide dismutase maakt van het zuurstofradicaal (superoxide)
waterstofperoxide en zuurstof met behulp van H+: 2 O2- + 2 H+ H2O2 + O2. Catalase maakt van het
gevormde waterstofperoxide water en zuurstof: 2 H2O2 H2O + O2. Superoxide dismutase en
catalase werken dus erg goed samen.
Verder spelen antioxidanten een rol in het onschadelijk maken van radicalen. Echter is het een
misvatting te denken dat extra antioxidanten (veel vitamines) radicalen nog meer onschadelijk
maakt. Waarschijnlijk werkt dat juist averechts.
Als eiwitten oxidatief gemodificeerd worden bevatten de aminozuren andere functionele groepen.
Reacties van radicalen met lipiden zorgen voor een andere membraansamenstelling.
Beide soorten DNA kunnen gemodificeerd worden: zowel chromosomaal DNA als mitochondrieel
DNA. Schade aan DNA is bijvoorbeeld deanimatie of de vorming van 8-oxo-guanine uit guanine, wat
leidt tot AT (in plaats van GC). Mitochondrieel DNA loopt veel sneller schade op dan chromosomaal
DNA, omdat mtDNA dichter bij de ROS-bron ligt, mitochondriën geen DNA-repairmechanismen
hebben en omdat er minder selectieve druk is bij mtDNA (er zijn meerdere kopieën van (hetzelfde)
DNA per mitochondrium).
Veroudering
Fouten in DNA door onder andere ROS leiden tot veroudering.
Veroudering door mutaties
Bij het ouder worden neemt het aantal fouten in het DNA toe en worden meer
verouderingsaandoeningen waargenomen. Dit verband werd duidelijk toen men waarnam dat
defecten in het DNA-repairsysteem zorgden voor verouderingen op jonge leeftijd (omdat er dus veel
sneller meer mutaties zijn).
11
Er zijn veel verschillende uiterlijke vormen van veroudering. Dit komt doordat meerdere genen
(waarin overal mutaties voor kunnen komen) het repairsysteem bepalen en doordat repairgenen niet
alleen aan of uit kunnen staan maar door mutaties ook gedeeltelijk kunnen functioneren.
Een voorbeeld van een verouderingsziekte is het Wernersyndroom. Oorzaak hiervan is een mutatie
in een helicase. Helicases hebben niet alleen een rol bij DNA-replicatie (blz.9) maar ook bij
telomeren, DNA-repair, transcriptie en zelfs chromosoomsegregatie.
Een andere verouderingsziekte is het Hutchinson-Gilford Progeriod Syndrome (HGPS). Oorzaak
hiervan is een mutatie in Lamine A, waardoor DNA-repair en heterochromatineopbouw
(condensatie, blz.2) wordt verstoord.
Veroudering door ROS
ROS zijn de grootste oorzaak van veroudering. Gedurende een mensenleven neemt de schade van
ROS namelijk cumulatief toe. In oudere organismen worden namelijk meer geoxideerde eiwitten
aangetroffen en komen verouderingsziekten vaker voor. De schade in mitochondriën is zelfs direct
exponentieel: bij slechter mtDNA werken de mitochondriën minder goed met als gevolg een slechter
functionerende elektronentransportketen en dus meer vrije radicalen.
Samenvattend: ROS zijn een noodzakelijk onderdeel van cellulaire processen, maar teveel aan ROS
leidt tot oxidatieve stress door DNA- eiwit- en lipideveranderingen. Bescherming wordt geboden
door antioxidanten en repairenzymen. Met verloop van tijd wordt de schade steeds groter
(cumulatieve schade aan DNA, eiwitten en mitochondriën) en dit is een irreversibel proces.
Celveroudering
De besproken veroudering heeft als gevolg
dat hele cellen verouderen. Een kenmerk
van cellulaire veroudering is het steeds
korter worden van telomeren (telomeren:
zie blz.9). Als telomeren tekort worden
wordt het DNA beschadigd. Gevolg
hiervan is dat de meeste cellen doodgaan
(ze delen dus nu niet meer verder), maar
soms worden de cellen toch onsterfelijk.
Omdat deze cellen wel weer kunnen delen
treedt er automatisch selectiedruk op
voor onsterfelijke cellen. Bij deze cellen
worden de telomeren nog steeds wél
korter. Dit leidt onmiddellijk tot
veroudering. Andere oorzaken van
veroudering zijn DNA-schade, oxidatieve stress, oncogeenactiviteit, onvoldoende cel-celcontact en
een tekort aan voedingsstoffen.
Veroudering heeft als gevolg dat bindweefsel in mindere mate kan worden gemaakt of juist
afgebroken en bovendien kan de aanwezigheid van verouderde cellen normale weefselopbouw
verstoren. Mogelijke oplossingen hiervoor zijn: langer maken van telomeren of het kunstmatig
verwijderen van oude cellen.
SMITS (gastcollege)
Agrobacterium tumefaciens (‘die tumoren maakt’)
Agrobacterium tumefaciens is een staafvormige, gramnegatieve bacterie. De bacterie zet de plant
aan tot het maken van opines waarop de bacterie kan groeien. Dit zorgt voor tumorvorming bij de
plant. Het pTi-plasmide bevat o.a. een T-regio met cytokines en auxines (groeistimulatie) en een
virulentieregio. Het infectieproces (bacterieplant) verloopt in 4 stappen:
1) Inductie van vir-genen
2) Processen van het T-DNA
12
3) T-DNA-transport naar de gastheer
4) Integratie van het T-DNA.
1)
Zodra de bacterie via VirA plantenstoffen waarneemt (suikers, lage pH, fenolische
verbindingen – komen vrij uit gewonde plantencellen) draagt VirA die stoffen over aan VirG
die daarop actief wordt en virulentiegenen induceert. VirA en VirG werken dus als een
tweecomponentensysteem.
2) VirD procest vervolgens het T-DNA.
3) Het T-DNA-transport vindt plaats met behulp van het Type-4-secretiesysteem.
4) Integratie gebeurt vervolgens met het veelzijdige VirE2, dat o.a. als NLS (Nuclear Localization
Signal). Ook zorgt VirE2 berscherming van het T-DNA.
Agrobacterium is nuttig voor biotechnologie (omdat het planten aanzet tot groei). Bovendien is de
biotechnologie eenvoudiger dan de werkelijkheid omdat het voor biotechnologie voldoende is als de
vir- en T-regionen aanwezig zijn. Ze hoeven dus niet op hetzelfde plasmide te liggen.
Voorbeelden van gebruikte biotechnologie zijn Bt-mais en Flavr Savr tomaten.
Verbetering is nog wel wenselijk, omdat nu het T-DNA op random plaatsen integreert (vanwege nonhomologous end-joining principe (blz.10)). Er wordt gewerkt aan de combinatie met Zinc Finger
Nucleases, zodat er meer homologe recombinatie plaatsvindt.
Clostridum difficile (Cdiff)
Cdiff is een grampositeve, sporevormende bacterie. Hij veroorzaakt antibioticageassocieerde diarree
en is na terugval vaak lethaal. De terugval wordt veroorzaakt door sporulatie (vorming van
endosporen). Voor sporulatie is Spo0A erg belangrijk. Spo0A reguleert sporulatie via DNA-binding.
Toxine A en Toxine B zijn de belangrijkste virulentiefactoren. Deze toxines liggen gecodeerd op een
pathogeniciteitslocus waarop ook onder andere tcdR en tcdC liggen. tcdR is een σ-factor (σ-factoren
zorgen voor promotorherkenning (promoten transcriptie)). Na onderzoek bleek tcdC een anti-σfactor te zijn. Toch blijkt een knockout van tcdC weinig effect te hebben op de toxineproductie.
Voor de behandeling van Cdiff blijkt tcdC dus weinig perspectief te hebben.
Daarom is gekeken naar het ribosomaal RNA van Cdiff. Verschillende stammen van Cdiff verschillen
in intergenic space tussen 16S en 23S rRNA, dit worden verschillende ribotypes genoemd. Het blijkt
dat Cdiffs met ribotype 027 erg pathogeen zijn. Maar echte uitkomst biedt dit ook niet.
Als laatste is geopperd dat Cdiff misschien een zoönose zou zijn. Na onderzoek bij muizen te hebben
gedaan, blijkt dat een mix van bacteriën Cdiff tegen kunnen gaan. Dit heeft wél effect bij mensen:
bacteriotherapie heeft het aantal mensen dat genezen kon worden flink verhoogd!
13