2.1 Wat is licht?
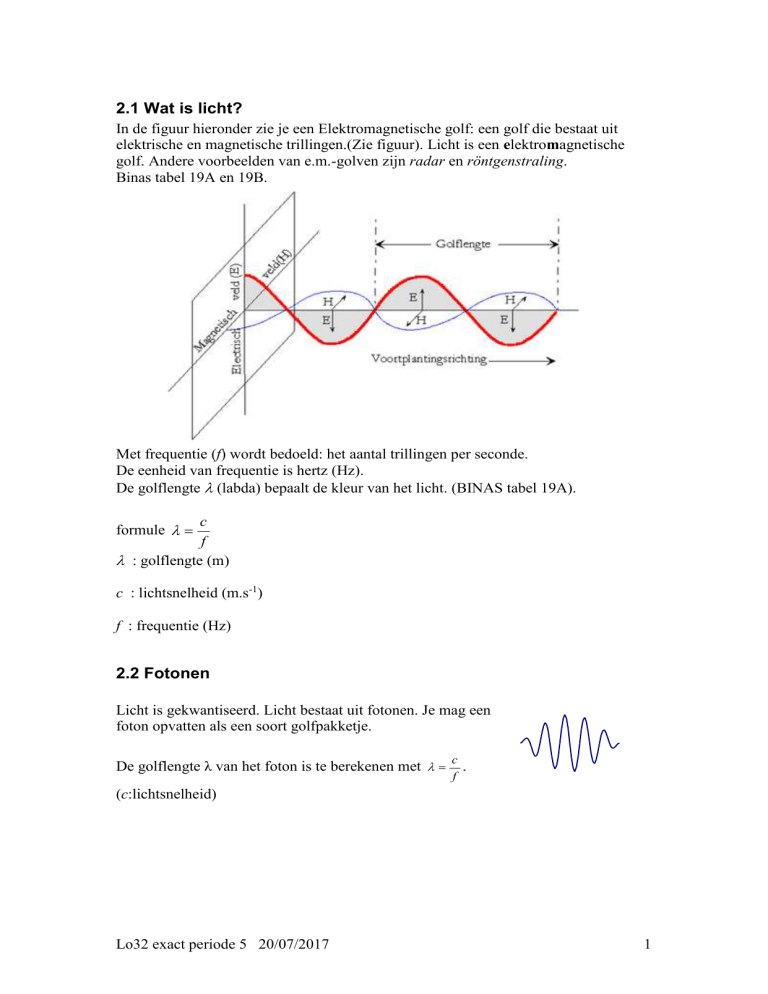
In de figuur hieronder zie je een Elektromagnetische golf: een golf die bestaat uit
elektrische en magnetische trillingen.(Zie figuur). Licht is een elektromagnetische
golf. Andere voorbeelden van e.m.-golven zijn radar en röntgenstraling.
Binas tabel 19A en 19B.
Met frequentie (f) wordt bedoeld: het aantal trillingen per seconde.
De eenheid van frequentie is hertz (Hz).
De golflengte (labda) bepaalt de kleur van het licht. (BINAS tabel 19A).
c
f
: golflengte (m)
formule
c : lichtsnelheid (m.s-1)
f : frequentie (Hz)
2.2 Fotonen
Licht is gekwantiseerd. Licht bestaat uit fotonen. Je mag een
foton opvatten als een soort golfpakketje.
De golflengte λ van het foton is te berekenen met
c
f
.
(c:lichtsnelheid)
Lo32 exact periode 5 20/07/2017
1
2.3 Wat is een spectrum?
Licht bestaat vaak uit een mengsel van kleuren (dus van verschillende golflengten).
Bij een spectrum worden de verschillende kleuren naast elkaar geprojecteerd.
Hoe maak je een spectrum?
Er zijn twee manieren om een
spectrum te maken.
1. Met een prisma:
verschillende golflengten
hebben ook een
verschillende
brekingsindex. De stralen
komen dus met een
verschillende hoek uit het
prisma.
2. Met een tralie:
Als licht op een CD-tje valt zie je een spectrum. Het
CD-tje werkt als een tralie. Een tralie bestaat uit een
glaasje met zeer veel evenwijdige krasjes (bijv 600 per
mm). Het licht dat op het tralie valt gaat door de
openingen tussen de krasjes. Daar vindt buiging plaats.
De gebogen lichtstralen interfereren.
Interferentie is: het versterken en verzwakken van de
golven. In bepaalde richtingen wordt rood versterkt, in
andere violet, enz.
2.4 Het continu spectrum
Fotonen wordt uitgezonden door gloeiende voorwerpen. (gloeidraad, gloeiende
koolstofdeeltjes in een kaarsvlam). Er ontstaat “wit”licht als de temperatuur hoog
genoeg is. Als van dit licht een spectrum wordt gemaakt zie je alle kleuren continu in
elkaar overlopen. Continu betekent: doorlopend, zonder onderbrekingen.
Lo32 exact periode 5 20/07/2017
2
2.5 De gasontladingslamp.
In een gasontladingslamp (zie figuur hieronder) bevindt zich een gas (bijvoorbeeld
Neon) of een damp (bijv natrium of kwik). Door de lamp stromen elektronen van de
min-elektrode naar de
plus-elektrode.
Kwikdamp
De elektronen bewegen
steeds sneller. Als ze
tegen een gas- of
dampatoom botsen kan dit
atoom in een aangeslagen
toestand komen.
Atomen in aangeslagen
ca 600V
toestanden zijn zeer labiel.
Na zeer korte tijd valt het atoom terug in de grondtoestand. Hierbij wordt een foton
uitgezonden.
2.6 Het emissiespectrum (lijnenspectrum)
Een emissiespectrum ontstaat als we atomen van een gas of damp blootstellen aan
botsingen van elektronen.
Fotonen worden uitgezonden door atomen die terug vallen van een aangeslagen
toestand (plaatje links) naar de grondtoestand (plaatje rechts).
foton
kern
kern
Een atoom in de grondtoestand heeft minder energie dan een atoom in een
aangeslagen toestand. Het energieoverschot komt vrij in de vorm van em-straling: een
foton. Een atoom heeft diverse aangeslagen toestanden. Ieder met een zeer bepaalde
energie. En de energie bepaalt de kleur .Vandaar dat het spectrum van een
gasontladingslamp uit enkele gekleurde strepen bestaat.
Zie Binas: 20- 3 t/m11 en 13
Lo32 exact periode 5 20/07/2017
3
Ieder gekleurde streep komt overeen met een energieovergang.
2.7 Het absorptiespectrum
Een absorptiespectrum ontstaat als licht van een gloeilamp (met een continu
spectrum) door een absorberende stof gaat. De stof absorbeert bepaalde kleuren
(golflengten) van het licht. Op die plaatsen ontstaat in het spectrum een zwarte streep.
Hierbij is het volgende belangrijk.
Atomen absorberen alleen de fotonen met de juiste energie. Dat wil zeggen fotonen
die ze zelf zouden uitzenden als ze vanuit een aangeslagen toestand terugvallen in de
grondtoestand. Absorptie speelt dus een belangrijke rol bij het herkennen van stoffen
(kwalitatief).Ook kwantitatief is absorptie belangrijk (AAS)
Hieronder zie je een schema hoe je een absorptiespectrum kan maken.
2.8 Hoe komt een atoom in een aangeslagen toestand?
Er zijn drie manieren om een atoom in een aangeslagen toestand te krijgen.
1. Door het atoom verwarmen (bijvoorbeeld in een gasvlam)
2. Door het atoom te laten botsen met elektronen (in een gasontladingsbuis)
3. Door het atoom licht te laten absorberen.
In alle gevallen valt het atoom terug in de grondtoestand en zendt een foton uit.
Lo32 exact periode 5 20/07/2017
4
2.9De elektronvolt (eV).
De energie eenheid joule (J) is niet erg geschikt voor de atomaire schaal.
De energie van een foton kan bij voorbeeld 4,12.10-19J zijn.
Daarom is de elektronvolt (eV) ingevoerd.
definitie:
1 eV = 1,60.10-19 J
De energie van foton uit het voorbeeld is 2,58 eV
Lo32 exact periode 5 20/07/2017
5
1.0
De zon staat (gemiddeld) 1,5.1011 m van ons af. Hoe lang is zonlicht onderweg
voordat het de aarde bereikt?
1.1
De golflengte van blauw licht in vacuüm is 490 nm.
Bereken de frequentie.
1.2
Licht met een frequentie van 3,8.1014 Hz kunnen we nog zien.
a. Bereken de golflengte
a. Kunnen we licht met een iets hogere frequentie ook zien?
2.3
Zijn de onderstaande stellingen waar?
I.
Bij interferentie worden golven altijd versterkt.
II.
Een prisma werkt met buiging van licht.
III.
In een prisma wordt blauw sterker gebroken dan rood
waar/ niet waar
waar/ niet waar
waar/ niet waar
4.1
Noem een lichtbron waarvan het spectrum continu is
4.2
Is het spectrum van de zon continu? Geef toelichting.
5.1
Hoe komt het dat een natriumlamp een andere kleur licht geeft als hij net is
ingeschakeld?
6.4
Hiernaast zie je een gedeelte van een
energieschema van een atoom.
Hoeveel spectraallijnen verwacht je in het
spectrum?.
E3
E2
E1
E0
Lo32 exact periode 5 20/07/2017
6
6.5
Niet alle spectraallijnen hebben dezelfde helderheid. Leg uit waardoor dat wordt
veroorzaakt.
8.1
Licht met golflengte tussen de 370nm en 800nm kunnen wij zien.
Bereken tussen welke energiegrenzen (in eV) zichtbare fotonen zich bevinden.
Lo32 exact periode 5 20/07/2017
7
2.10 De energie van een foton.
De energie van een foton is te berekenen met:
E foton h f
Hierin is:
Efoton de energie van het foton in J
h de constante van Planck :6,63.10-34 Js
f de frequentie van het foton
(BINAS tabel 7)
De golflengte λ van het foton is te berekenen met
c
f
. (c:lichtsnelheid)
De energie van fotonen is ook af te lezen uit energieschema’s van atomen.
Oefeningen .
1.
Een atoom gaat van energietoestand n=3 naar n=2.
Bereken het bijbehorende energieverschil in eV en in J.
Bereken de bijbehorende frequentie. Is dit foton zichtbaar?
2.
Hoe ziet een absorptie spectrum eruit?
a. Een continu spectrum met daarin zwarte lijnen.
b. Een paar gekleurde lijnen maar verdere helemaal zwart.
c. Alle kleuren van de regenboog gaan vloeiend in elkaar over.
d. Geheel zwart met één gekleurde streep.
Lo32 exact periode 5 20/07/2017
8












