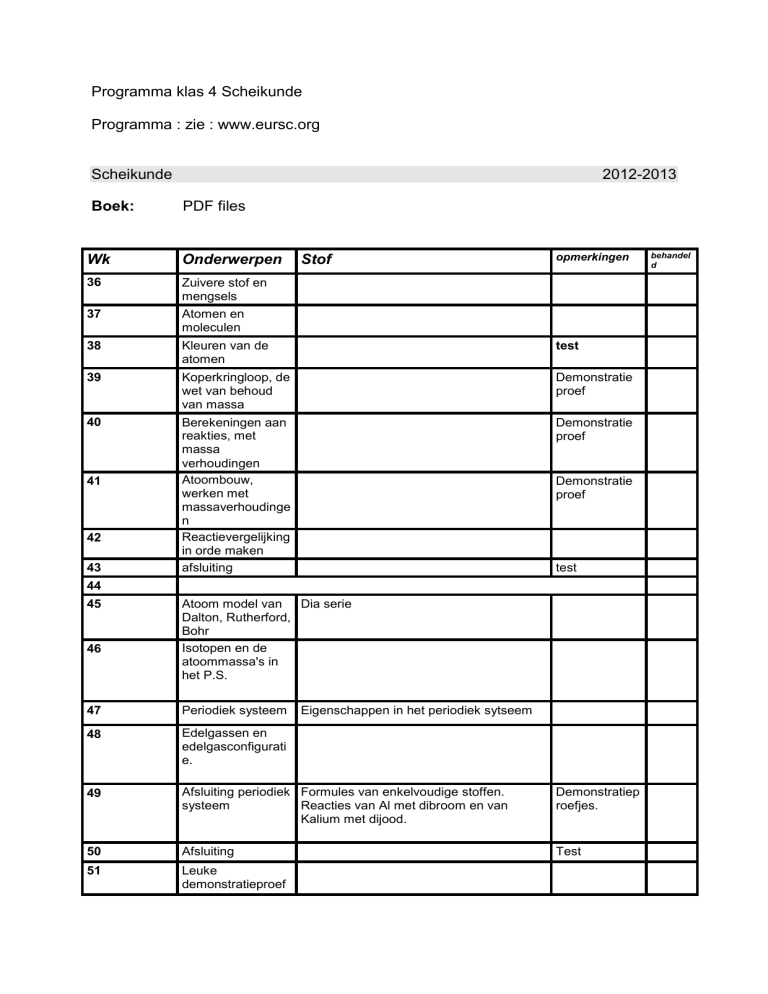
Programma klas 4 Scheikunde
Programma : zie : www.eursc.org
Scheikunde
2012-2013
Boek:
PDF files
Wk
Onderwerpen
36
Zuivere stof en
mengsels
37
Atomen en
moleculen
38
Kleuren van de
atomen
test
39
Koperkringloop, de
wet van behoud
van massa
Demonstratie
proef
40
Berekeningen aan
reakties, met
massa
verhoudingen
Atoombouw,
werken met
massaverhoudinge
n
Reactievergelijking
in orde maken
afsluiting
Demonstratie
proef
41
42
43
Stof
opmerkingen
Demonstratie
proef
test
44
45
46
Atoom model van Dia serie
Dalton, Rutherford,
Bohr
Isotopen en de
atoommassa's in
het P.S.
47
Periodiek systeem
48
Edelgassen en
edelgasconfigurati
e.
49
Afsluiting periodiek Formules van enkelvoudige stoffen.
systeem
Reacties van Al met dibroom en van
Kalium met dijood.
Demonstratiep
roefjes.
50
Afsluiting
Test
51
Leuke
demonstratieproef
Eigenschappen in het periodiek sytseem
behandel
d
52& 1
2
Inleiding zouten
De formule vinden van een binaire
ionverbinding. Methode
Vorming van magnesiumnitride. Formule
zoeken en reactievgl.
3
Zouten
De ionroosters van ionverbindingen. Vb.:
NaCl.
Kleine overhoring formules. Nomenclatuur
van binaire ionverbindingen.
Pseudobinaire
4
Zouten
5
Zouten
Eigenschappen van ionverbindingen.
Geleidingsvermogen
Samengestelde ionen. Formules en
namen.
Zouten en water: oplossen van
ionverbindingen en geleidingsvermogen
van de oplossing.
Animatie oplossen van NaCl. Oefeningen
ionverbindingen
6
Bindingen
De covalente binding in CO2. Gepaarde
en ongepaarde elektronen.
8
Lewisstructuur
Reactie van waterstofgas met zuurstofgas.
Lewis structuurformules opstellen. H2O,
NH3, HCl, O2, N2, Cl2, H2.
9
Lewisstructuur
Vorm van H2O, NH3, CH4, P4 en S8.
De structuur van P4. Verbranding van
zwavel en fosfor.
10
Uitloop
11
Bindingen
Eigenschappen van moleculaire stoffen.
Elektronegativiteit.De polaire covalente
binding.
12
Polaire bindingen
De polaire binding en dipoolmoleculen.
H2O; CO2; NH3.
De aggregatietoestanden van moleculaire
stoffen.
15
Dipolen
Dipolen, H-bruggen en
aggregatietoestanden.
Nomenclatuur van moleculaire stoffen.
Ook peroxiden.
16
Uitloop
17
Moleculaire stoffen Oefeningen kookpunt van moleculaire
Demonstratiep
roefjes.
7
Demonstratiep
roeven.
13
14
Test
stoffen. Metalen: begin.
18
Moleculaire stoffen Testje nomenclatuur moleculaire stoffen.
Metalen: dichtste bolstapeling.
19
Metalen
20
afsluiting
21
Alkanen en
alkenen
Koolstofchemie: indeling van de
koolstofverbindingen. I. De
koolwaterstoffen. De reeks van de
alkanen.
De nomenclatuur van de vertakte alkanen.
23
Alkanen en
alkenen
Koolstofchemie: oefeningen nomenclatuur
vertakte en onvertakte alkanen.
De alkanen: fysische eigenschappen.
Kookpunt en oplosbaarheid.
24
Alkanen en
alkenen
De alkanen: types van chemische reacties.
Reacties met halogenen: inleiding.
De metalen: eigenschappen, reactiviteit.
De reacties van binaire verbindingen met
enkelvoudige stoffen: verdringingsreacties.
1) CuO + Al
Test
22
De reacties van alkanen: reactie met
dibroom en verbranding.
25
Alkanen en
alkenen
De onverzadigde KWS. Alkenen.
Nomenclatuur en additiereacties.
26
Afsluiting
test
27












