Samenvatting Moleculen en Reactiviteit
Niek Groot
Moleculen & Reactiviteit
13 februari 2012
Alkenen
Alkenen zijn onverzadigde koolwaterstoffen waarin één paar
koolstofatomen verbonden is door een dubbele binding. Alkenen
met één zo'n dubbele binding en geen andere functionele groepen
hebben de algemene verhoudingsformule CnH2n.
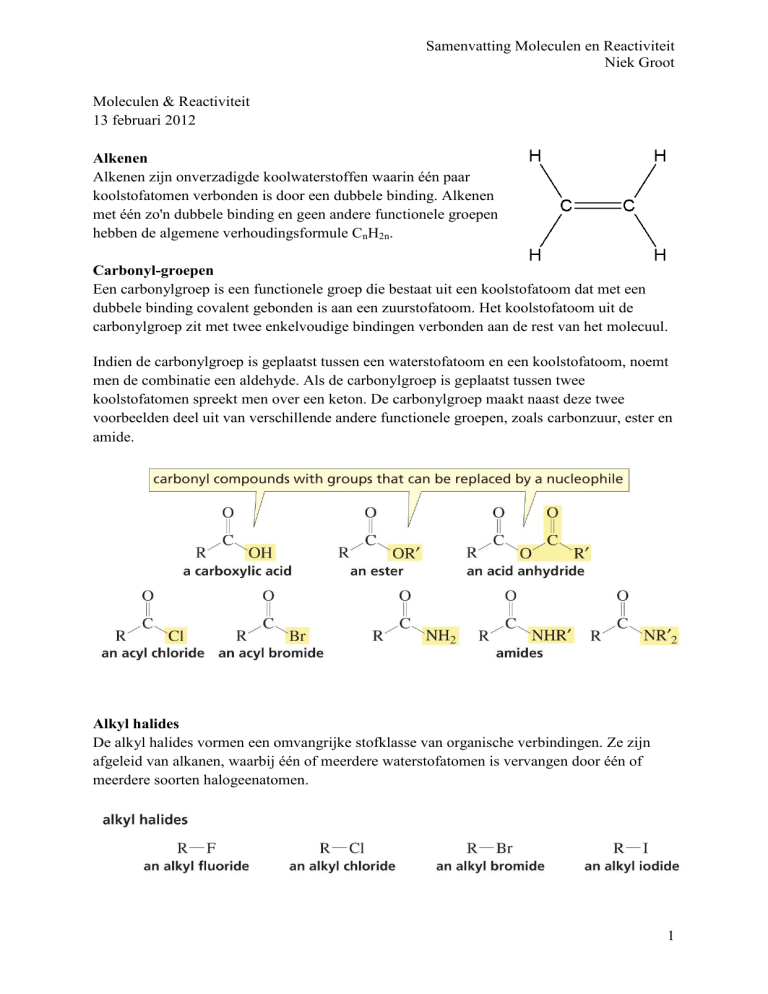
Carbonyl-groepen
Een carbonylgroep is een functionele groep die bestaat uit een koolstofatoom dat met een
dubbele binding covalent gebonden is aan een zuurstofatoom. Het koolstofatoom uit de
carbonylgroep zit met twee enkelvoudige bindingen verbonden aan de rest van het molecuul.
Indien de carbonylgroep is geplaatst tussen een waterstofatoom en een koolstofatoom, noemt
men de combinatie een aldehyde. Als de carbonylgroep is geplaatst tussen twee
koolstofatomen spreekt men over een keton. De carbonylgroep maakt naast deze twee
voorbeelden deel uit van verschillende andere functionele groepen, zoals carbonzuur, ester en
amide.
Alkyl halides
De alkyl halides vormen een omvangrijke stofklasse van organische verbindingen. Ze zijn
afgeleid van alkanen, waarbij één of meerdere waterstofatomen is vervangen door één of
meerdere soorten halogeenatomen.
1
Samenvatting Moleculen en Reactiviteit
Niek Groot
Orbitalen
Een orbitaal is een begrip in de natuurkunde om min of meer aanschouwelijk betekenis te
geven aan de baan van een elektron in een atoom. In het klassieke atoommodel bevond een
elektron zich in een schil, een bolvormig gebied rondom de kern. In de kwantummechanica
wordt de positie van een elektron in een geïsoleerd atoom beschreven door de golffunctie van
dat elektron. Door deze golffunctie, die zelf ook als orbitaal wordt aangeduid, wordt een
kansverdeling gegeven over de mogelijke posities van het elektron. In principe bestaat de
mogelijkheid het elektron op zeer grote afstand van de kern aan te treffen, maar de kans
daarop is zeer gering. De waarschijnlijkste posities, met gezamenlijk een kans van 90% om
het elektron er aan te treffen, vormen het orbitaal. Het is het trefkansgebied van een elektron
binnen de grenzen van het atoom.
Valentie elektronen
Een valentie-elektron is een elektron dat zich in een nog niet helemaal opgevulde
elektronenschil, de valentieschil, van een atoom bevindt.De valentie-elektronen worden door
de al wel volle schillen van de positieve atoomkern afgeschermd. De valentie-elektronen
"zien" dus een kernlading die veel kleiner is dan de werkelijke lading, en bovendien bevinden
zij zich veel verder van de atoomkern. Valentie-elektronen worden daarom makkelijk
afgestaan. Chemische elementen met evenveel valentie-elektronen staan onder elkaar in de
periodiek systeem en hebben gelijkaardige chemische eigenschappen. In het natriumatoom
(zie figuur hiernaast) vullen de eerste 10 elektronen samen
de eerste twee schillen volledig op. Het elfde elektron dat
nodig is om het atoom neutraal te maken is het valentieelektron, het is boven in de derde schil getekend. Het
bevindt zich in de volgende baan, ver van de kern. Het
negatieve valentie-elektron "ziet" de positieve kern
nauwelijks: de 11+ kern wordt door 10 elektronen effectief
tot een 1+ kern gereduceerd. Het valentie-elektron wordt
daardoor makkelijk afgestaan, natrium komt in de natuur
uitsluitend voor als éénwaardig positief ion: het valentieelektron maakt deel uit van de elektronen rond een ander
atoom, chloor bijvoorbeeld.
2
Samenvatting Moleculen en Reactiviteit
Niek Groot
Opvullen van verschillende orbitalen
De vorm van de golffunctie is verschillend voor de aanduiding s, p, d enz. Door het
uitsluitingsprincipe van Pauli kunnen geen elektronen naast elkaar bestaan met exact dezelfde
golffunctie. Door de eigenschap spin van het elektron kunnen er wel twee elektronen zich
bevinden in de subschil s. Namelijk het elektron met spin up en het andere elektron met spin
down. Dit geldt voor iedere schil op het laagste niveau: de 'magnetische' subschil.
De schillen worden opgevuld met elektronen, naarmate het atoom zwaarder (meer elektronen
heeft) bevat. Hierbij wordt door de elektronen steeds de laagste energietoestand aangenomen.
Hierdoor wordt meestal een dichter tegen de kern gelegen schil volledig opgevuld, voordat
een elektron plaats neemt op een schil dat verder van de kern gelegen is. In de afbeelding
hieronder is goed te zien hoe de verschillende orbitalen worden opgevuld. Merk hierbij op dat
de P orbitalen één voor één, één elektron krijgen. Het is dus niet zo dat de Px orbitaal in
koolstof al twee elektronen bezit. Eerst zullen Py en vervolgens Pz (bij stikstof) beiden één
elektron krijgen. Pas vanaf zuurstof (8 protonen en dus 8 elektronen bij een
edelgasconfiguratie) zal de Px orbitaal worden aangevuld met een tweede elektron.
Wanneer een schil niet volledig is opgevuld met elektronen (bij de eerste schil alleen 1s en bij
de tweede schil dus 2s, 2px, 2py en 2pz) noemt men de al aanwezige elektronen, valentie
elektronen (ga na dat zuurstof 6 valentie elektronen bevat).
*Note to self: De horizontale rijen in het periodiek systeem staan voor het aantal schillen
elektronen.
3
Samenvatting Moleculen en Reactiviteit
Niek Groot
Aufbau principe, Pauli exclusion principe en Hund’s regel
According to the principle, electrons fill orbitals starting at the lowest available (possible)
energy states before filling higher states (e.g. 1s before 2s). The number of electrons that can
occupy each orbital is limited by the Pauli exclusion principle (dit principe houdt in dat er
zich maar twee elektronen per orbitaal kunnen bevinden, met opposide spin. If multiple
orbitals of the same energy are available, Hund's rule states that unoccupied orbitals will be
filled before occupied orbitals are reused (by electrons having different spins).
Theorie van Lewis
De Lewistheorie is een van de oudste theorieën over chemische binding. In 1916 publiceerde
hij een lang artikel. In dit artikel nam hij enige postulaten op waarin o.a. is beschreven dat
een neutraal atoom bestaat uit een atoomromp en een aantal elektronen in een buitenste schil.
Het aantal elektronen in die buitenste schil is gelijk aan de positieve lading van de
atoomromp en ligt tussen 0 en 8. De elektronen in de buitenste schil zijn later valentieelektronen genoemd. Een atoom of ion heeft de edelgasconfiguratie als het 8 valentieelektronen heeft. In datzelfde artikel definieerde Lewis de essentie van de covalente binding,
de binding die verantwoordelijk is voor de vorming van moleculen door atomen:
Een covalente binding is een tweetal elektronen dat gemeenschappelijk bezit is van twee
atomen.
In de meeste gevallen draagt elk atoom één elektron bij aan dat tweetal gemeenschappelijke
elektronen. In sommige gevallen echter levert één atoom beide elektronen. Dat tweetal
elektronen heet nu “elektronenpaar”. In beide situaties bevindt het gemeenschappelijk
elektronenpaar zich tussen beide atomen. Omdat dat elektronenpaar beide atoomkernen
aantrekt worden volgens Lewis ook beide atomen naar elkaar toe getrokken. Omdat lithium
maar één valentie elektron heeft, zal hij deze graag af willen staan om zo zijn eerste schil vol
te krijgen (gunstiger dan 7 elektronen regelen). Omdat fluor al 7 elektronen in zijn tweede
schil heeft zitten (2pz mist er nog één), is het voor fluor gunstiger om een elektron op te
nemen, dan om er 7 af te staan. Daarom zal fluor vaak als een negatief geladen ion
voorkomen.
4
Samenvatting Moleculen en Reactiviteit
Niek Groot
Ionbinding
De elementenatomen streven in hun buitenste
elektronenschaal de edelgasconfiguratie s2p6 (bij hogere
chemische elementen vanaf gallium ook een gesloten
s2p6d10 elektronenconfiguratie) aan. Dit kan bereikt
worden door een elektronenafgifte; hierbij ontstaan
eenvoudig of meervoudig positief geladen kationen. Ook
kan dit bereikt worden door elektronenopname, waarbij
eenvoudig of meervoudig negatief geladen anionen
ontstaan. Omdat deze ionen hun buitenste schil al
helemaal vol hebben, zullen ze geen covalente binding
vormen, maar elkaar aantrekken door een elektrostatische
kracht. Een ionbinding treedt op wanneer het verschil in
elektronegativiteit groter is dan 1,7.
Covalente binding
Een covalente binding (of atoombinding) is een
binding tussen atomen waarin de atomen een of
meer gemeenschappelijke elektronenparen hebben.
Niet-metalen gaan met elkaar covalente bindingen
aan. Met deze vorm van binding worden
moleculen of een samengesteld ion opgebouwd.
Als vuistregel kan gesteld worden dat een
covalente binding optreedt als het verschil van
elektronegatieve waarden kleiner is dan 1,7.
Elektronegativiteit
De elektronegativiteit (EN) is een maat voor de neiging van een atoom dat een chemische
binding aangaat met een buuratoom om de gezamenlijke elektronenwolk naar zich toe te
trekken.Wanneer twee gelijke atomen een molecuul vormen, bijvoorbeeld een
waterstofmolecule (H-H) of een fluormolecule (F-F), dan trekken zij met evenveel
elektronische kracht aan de elektronenwolk. Het molecuul heeft dan geen dipoolmoment μ:
de binding is covalent. De binding in de HF-molecule is echter polair. De elektronenwolk
wordt meer naar het fluoratoom toegetrokken dan naar het waterstofatoom. Dit komt doordat
de ionisatiepotentiaal en de elektronenaffiniteit van de beide elementen verschillend is. We
zouden ook kunnen zeggen dat statistisch gesproken voor een deel van de tijd het molecuul
bestaat uit een H+ (waterstof doneert het elektron aan fluor) en een F- ion.
5
Samenvatting Moleculen en Reactiviteit
Niek Groot
Dipoolmoment
Het dipoolmoment is een kwantitatieve maat voor de polariteit van een binding of van een
molecuul. In het laatste geval heet dit het moleculaire dipoolmoment. Binnen een molecuul,
dat op zich neutraal is, kan de lading zich verdelen tussen de verschillende atomen doordat
een atoom harder aan de elektronen zuigt dan de andere. Dit wordt veroorzaakt door de
verschillende elektronegativiteiten van de atomen. De ene kant krijgt een beetje pluslading en
de andere kant wordt een beetje min. Zo vormt zich een dipoolmoment en het molecuul is
dan een dipool. In de formule hieronder is ‘e’ de grootte van de lading en ‘d’ de afstand
tussen de twee atomen (ladingen). Hierin wordt het dipoolmoment (μ) uitgedrukt in Debye
(D). Omdat de lading op een elektron 4.80 x10-10 esu is en de afstand tussen twee ladingen in
10-8 cm moet worden uitgedrukt, kun je een dipoolmoment van (bijvoorbeeld) 1.5 x 10-8 esu
cm gelijkstellen aan 1.5 D. Je moet wel onthouden dat hier met centimeters wordt gerekend
en NIET met meters.
Dipool moment (μ) = e x d
Formal charge
In de scheikunde, is formele lading (formal charge, FC) de lading die aan een atoom in een
molecuul of samengesteld ion wordt toegekend met als uitgangspunt dat elektronen in een
chemische binding gelijkwaardig worden gedeeld door de atomen, zonder rekening te houden
met verschil in elektronegativiteit.
De formele lading van elk atoom in een molecuul of samengesteld ion kan m.b.v. de
volgende formule worden berekend:
Hierbij is V het aantal valentie-elektronen van een geïsoleerd atoom in
de grondtoestand; N is het aantal niet-bindende valentie-elektronen van dat atoom in een
molecuul of samengesteld ion en B is het totaal aantal gemeenschappelijke valentieelektronen van dat atoom in covalente bindingen met andere atomen in het molecuul of
samengesteld ion. Een covalente binding heeft twee gemeenschappelijke elektronen. Ga dit
na voor het hydronium ion hiernaast (antwoord = +1). V= 6, N=2 en B=6.
S-orbitalen
Orbitalen vertellen ons in welk
volume de kans het grootst grootst is
om een elektron uit diezelfde schil te
vinden. Bij elektronen uit de S-schil
is dit volume bolvormig (zie
afbeelding hiernaast).
6
Samenvatting Moleculen en Reactiviteit
Niek Groot
P(2)-orbitalen
Net als elektronen uit de S-schil, hebben de elektronen uit de P2x/y/z schil ook een volume
waar de kans het grootst is dat deze elektronen gevonden zullen worden. De laagste orbitaal
is 2p; deze vertoont een haltervorm, waarvan het knooppunt samenvalt met de atoomkern. Er
is 1 knoopvlak dat midden tussen de twee armen van de halter loopt.
Sigma binding (S-S)
Een sigma-binding is een vorm van covalente binding tussen twee atomen. In de sigmabinding treedt een moleculaire orbitaal waarbij de elektronendichtheid langs de verbindingsas van de twee atomen ligt. Deze vorm van binding tussen atomen wordt vooral aangetroffen
in de organische chemie tussen de koolstofatomen. Dit combineren van twee atomen kan ook
fout gaan omdat de ‘elektronengolven’ niet in fase zijn (destructive combination, zie
afbeelding onderaan deze pagina).
7
Samenvatting Moleculen en Reactiviteit
Niek Groot
Sigma binding (P-P)
Deze sigmatische binding tussen twee atomen is vrijwel exact hetzelfde als bij een S-S sigma
binding, alleen zijn het hier geen S-orbitalen die ‘fuseren’, maar P-orbitalen.
Pi Binding
Deze verbinding kan alleen ontstaan tussen twee P-P orbitalen. Hierbij komen twee P
orbitalen parallel naast elkaar te liggen, zodat ze niet verticaal (P-P sigma binding), maar
horizontaal fuseren (Pi-binding).
8
Samenvatting Moleculen en Reactiviteit
Niek Groot
Hybridisatie
Hybridisatie is het combineren van elektronenorbitalen van een atoom.Wanneer de s orbitaal
mengt met drie p orbitalen, worden 4 sp3
orbitalen gevormd alsof het atoom het midden
vormt van een tetraëder met de hybrideorbitalen wijzend naar de vier punten. Om dit te
realiseren moeten de S en de P orbitalen
fuseren, omdat S-orbitalen op zich zelf niet
direct met P-orbitalen kunnen fuseren. Het
ontstaande product (een SP3 orbitaal), is in staat
om met zowel P-orbitalen als met andere SP3-orbitalen een covalente binding te vormen. Bij
de hybridisatie van 4 orbitalen (S,Px,Py en Pz) zullen er dus 4 SP3-orbitalen gevormd
worden. De ‘S’ in SP3 zal dus ¼ S vanuit de S-orbitaal bevatten (idem voor de P’s).
9
Samenvatting Moleculen en Reactiviteit
Niek Groot
Complexere orbitalen
Tot nu toe had ik alleen nog maar de SP3-orbitalen besproken. Toch zijn er meer
mogelijkheden, namelijk de SP2 en de SP-orbitalen.
Wanneer de S-orbitaal mengt met een enkele P-orbitaal, worden 2 SP-orbitalen
gevormd (één naar links en één naar rechts), en blijven er loodrecht daarop 2 p
orbitalen over. (1 sigma-binding + 2 pi- bindingen)
Wanneer de S-orbitaal mengt met twee P-orbitalen, worden 3 SP2 orbitalen gevormd
(onder 120° in een vlak), en blijft er loodrecht op dat vlak 1 p orbitaal over. (1 sigmabinding + 1 pi-binding)
Wanneer de S-orbitaal mengt met drie P-orbitalen, worden 4 SP3 orbitalen gevormd
alsof het atoom het midden vormt van een tetraëder met de hybride-orbitalen wijzend
naar de vier punten. (1 sigma-binding enkel)
Orbitalen en dubbele bindingen
Twee orbitalen (hybride of atoomorbitalen) met een soortgelijke symmetrie, die in naast
elkaar liggende atomen liggen, kunnen tot een binding leiden. Er kunnen zelfs meerdere
paren orbitalen tussen hetzelfde paar atomen worden gevormd, dit is een meervoudige
binding. De eerste binding tussen twee atomen wordt een σ-binding genoemd. Een sigmabinding wordt gekenmerkt door een overlapzone met de grootste elektronendichtheid
gesitueerd op de bindingslijn tussen de twee atomen. Dit gebeurt wanneer de orbitalen elk
naar het andere atoom "wijzen". Er is een rotatiesymmetrie om een σ-type binding, en de
overlap tussen de orbitalen blijft bij rotatie bestaan.
10
Samenvatting Moleculen en Reactiviteit
Niek Groot
Indien er meer dan één binding is tussen twee atomen (bijvoorbeeld in C2H4 en N2)
overlappen de orbitalen die daarvoor verantwoordelijk zijn aan twee kanten van de bindingsas (boven en onder het vlak, of voor en achter het vlak). Deze bindingen worden π-bindingen
genoemd. Wanneer er een π-binding tussen twee atomen zit, heeft die binding geen
rotatievrijheid meer (draaien om de binding zou de overlap tussen de orbitalen verminderen).
In de afbeelding onderaan de vorige pagina is te zien hoe er op orbitale wijze een dubbele
binding tussen de twee C-atomen in etheen ontstaat. Om te checken of je dit snapt, moet je
even nagaan of je begrijpt waarom het C-atoom in CO2 een SP-orbitaal heeft (i.p.v. een SP2orbitaal).
Een dubbele binding bestaat altijd uit een π-binding en een SP2-binding
(gewoon aannemen).
π-bindingen worden meestal gevormd door
ongehybridiseerde p-orbitalen op de twee
atomen. Als 2 atomen dus één dubbele binding
vormen, zullen de rest van de orbitalen (1 s en
2 p orbitalen) tot sp2 hybridiseren.
Orbitaal
SP
SP2
SP3
Niet gehybridiseerd
Hoek (graden)
180
120
109.5
90
Een driedubbele binding bestaat altijd uit twee π-bindingen en een SP-binding
(gewoon aannemen).
Ongebonden elektronenparen
Water dankt zijn ruimtelijke structuur aan
de twee ongebonden elektronenparen van
het zuurstofatoom. Dit komt omdat beide
ongebonden elektronenparen een SP3orbitaal met het zuurstofatoom vormen.
Dit geldt ook voor NH3 en NH4+.
11
Samenvatting Moleculen en Reactiviteit
Niek Groot
Zuur
Een zuur is in de scheikunde een stof die protonen (H+-ionen) af kan staan. Wat er overblijft
is de negatieve zuurrest. Zuren zijn de tegenhangers van de basen. Een waterige oplossing
wordt zuur genoemd wanneer de pH lager is dan 7.
Men ontdekte daarbij dat het feit dat azijnzuur een zwakker zuur is dan zwavelzuur zich
manifesteerde in het feit dat azijnzuur zich in water maar ten dele splitste in CH3COO- en H+
terwijl bij zwavelzuur de splitsingsgraad veel hoger was. Dit maakte het mogelijk de sterkte
van zuren op een kwantitatieve schaal te brengen door het meten van de evenwichtsconstante
van het dissociatie-evenwicht. De sterkte van een zuur kan afgelezen worden uit
getabelleerde waarden van Ka.
CH3COOH
H+ + CH3COO-
Zuurconstante
De zuurconstante is een kwantitatieve maat voor de sterkte van een
zuur. Voor een oplossing van een (zwak) zuur, HZ, in water geldt
de evenwichtsvoorwaarde. Hier geldt: Hoe groter de waarde van
Ka, des te sterker het zuur (ga dit na). Vaak vindt men ook de pKa- of de pKz-waarde. Dit is,
analoog aan de pH-waarde, de negatieve logaritme van pKa = − log(Ka). Hiervoor geldt hoe
kleiner pKa, des te sterker het zuur. De pKa waarde geeft bovendien aan bij welke pH juist de
helft van de zuurmoleculen zijn H+ heeft afgestaan.
De invloed van substituanten op de zuurgraad
In de scheikunde is inductieve stabilisatie of het inductieve effect een experimenteel
vastgesteld effect waarbij ladingen doorgegeven worden door een opeenvolging van atomen
middels elektrostatische inductie. In de chloorgesubstitueerde ethaanzuren (aantal
chlooratomen) en propaanzuren (afstand tot de zuurgroep) is het effect te zien van de
elektronenzuigende werking van chloor op de zuurconstante. Ga ook na dat de kracht van de
base toeneemt (en dus de kracht van het zuur af), wanneer de substituant verder van de
carboxylgroep afzit.
12
Samenvatting Moleculen en Reactiviteit
Niek Groot
Delokalisatie
Een gedelokaliseerd elektron is een elektron in een
molecuul of een vaste stof dat niet bij een specifiek
atoom of een specifieke covalente binding hoort, maar
is "uitgesmeerd" over het molecuul. Dit verschijnsel
noemt men delokalisatie. Ruwweg kunnen de
elektronen in een molecuul in twee groepen worden
verdeeld: elektronen die in lagere schillen in de atomen zitten, en sterk aan een atoom
gebonden zijn, en de elektronen die de covalente bindingen verzorgen. De
valentiebindingstheorie beschrijft dit in termen van orbitalen: de orbitalen van twee atomen
overlappen gedeeltelijk, wat energetisch voordelig kan zijn. In dat geval ontstaat er een
binding tussen de twee atomen. Hierbij treedt bijna altijd hybridisatie op: mengvormen van
verschillende typen orbitalen geven een grotere overlap, daarmee een lagere energie en een
stabielere binding. In bepaalde gevallen wordt de overlap zo groot dat deze beschrijving niet
meer opgaat: in de toestand met de laagste energie (grondtoestand) strekken orbitalen zich
over meerdere atomen uit. Elektronen in deze orbitalen kunnen eenvoudig van het ene naar
het andere atoom gaan en zijn dus niet meer "gelokaliseerd".
Vanderwaalskrachten
De vanderwaalskrachten zijn zwakke tot zeer zwakke krachten tussen atomen of moleculen,
genoemd naar de Nederlandse natuurkundige Johannes Diderik van der Waals. De kracht is
relatief klein; de grootte ervan hangt sterk af van het gemak waarmee de elektronenwolk
vervormd kan worden (polariseerbaarheid), om zo de tijdelijke dipolen te vormen. Grote
atomen of moleculen zijn eenvoudig polariseerbaar: ze bezitten veel elektronen, waarvan een
gedeelte zich ver van de atoomkern bevindt, en dus zijn de vanderwaalskrachten groter (je
kunt gemakkelijker meer elektronen aan één kant van het molecuul krijgen, waardoor er een
kort dipoolmoment ontstaat).
Dipool-dipool interacties
Voor polaire moleculen is het niet moeilijk de
aard van hun interactie vast te stellen. De
positieve kant van het ene molecuul wordt
aangetrokken door de negatieve kant van het
andere molecuul en omgekeerd. Dit noemen we
een dipool-dipool-interactie en die berust op de electrostatische interactie tussen tegengesteld
geladen delen van de moleculen. Dit is vergelijkbaar met de aantrekking tussen de
tegengestelde polen twee magneten. Je moet begrijpen dat dipool-dipoolinteracties ontstaan
naar aanleiding van een verschil in elektronegatieviteit tussen twee atomen binnen een
molecuul. Je zult misschien denken dat deze kracht groter is (en de stof een hoger kookpunt
krijgt), wanneer de elektronegativiteit tussen de twee desbetreffende elektronen hoger is. Dit
is echter niet het geval. Het blijkt dat de stof een hoger kookpunt heeft, wanneer het verschil
in elektronegativiteit kleiner is. Waarom? Geen idee, gewoon onthouden.
13
Samenvatting Moleculen en Reactiviteit
Niek Groot
Waterstofbruggen
Een waterstofbrug is een intermoleculaire kracht tussen een elektronenpaar op een sterk
elektronegatief atoom (zuurstof, stikstof of fluor) en een naburig H-atoom gebonden aan een
ander sterk elektronegatief atoom. Ondanks dat de naam dit doet vermoeden, komen
waterstofbruggen, ook aangeduid als H-bruggen, dus niet uitsluitend voor tussen
watermoleculen. In het geval van fluor zijn ze zelfs beduidend sterkerIs een waterstofatoom
verbonden aan een atoom met een zeer grote elektronegativiteit, zoals F, O of N (zelfs C in
sommige gevallen) dan wordt de binding sterk polair. De elektronenwolk verschuift dan in de
richting van F, O of N en dit atoom wordt negatief geladen. Het resultaat is dat het aan F, O,
of N verbonden waterstofatoom positief wordt geladen. Omdat het waterstofatoom zo klein
is, is de lading erop sterk geconcentreerd, zodat het met grote kracht een naburig
dipoolmolecuul (of zelfs een dipool in hetzelfde molecuul) zeer dicht aan kan trekken.
Begrijp wel dat een H-brug acceptor een ongebonden elektronenpaar moet hebben (SP3).
Als het goed is moet
je nu uit kunnen
leggen waarom een
primair amine een
hoger kookpunt heeft
dan een tertiair
amine. Dit komt
omdat een primair amine slechts één methylgroep gebonden heeft. Hierdoor blijven er nog 2
H-donoren en nog 1 H-receptor over. Aangezien een secondair amine twee methylgroepen
gebonden heeft, blijft er hier nog maar één H-donor over, waardoor dit molecuul minder Hbruggen kan aangaan, wat een lager kookpunt als gevolg heeft (moleculen blijven niet goed
aan elkaar ‘plakken’.
14
Samenvatting Moleculen en Reactiviteit
Niek Groot
Stereochemie van alkanen
In de organische chemie verwijst een geëclipseerde conformatie (vaak aangeduid met de
Engelse term eclipsed) naar een specifieke conformatie, waarbij de substituenten (veelal
waterstofatomen) van 2 opeenvolgende koolstofatomen in een koolstofketen achter elkaar
geschikt staan. Dit komt voornamelijk tot uiting bij de constructie van de Newmanprojectie.
Daarbij is duidelijk te zien dat de substituenten elkaar sterisch hinderen. De
elektronenwolken komen in elkaars vanderwaalsstraal te zitten, wat een afstoting
veroorzaakt. Dat zorgt ervoor dat de geëclipseerde conformatie een stuk onstabieler is dan de
staggered conformatie (ongeveer 12,5 kJ/mol). Dergelijke conformaties komen voor bij sp3gehybridiseerde koolstofatomen, omdat er een vrije draaibaarheid ontstaat aan de sigmabinding. Bijgevolg kunnen een groot aantal conformaties worden aangenomen, waaronder de
onstabiele geëclipseerde conformatie.
Hyperconjugatie
In organic chemistry, hyperconjugation is
the interaction of the electrons in a sigma
bond (usually C–H or C–C) with an
adjacent empty (or partially filled) nonbonding p-orbital or antibonding π orbital
or filled π orbital, to give an extended
molecular orbital that increases the stability
of the system. Hyperconjugatie zorgt er ook
voor dat de staggered conformatie een meer stabiele conformatie is dan de eclipsed
conformatie. Dit komt omdat de SP3 orbital (C-H) een elektroninteractie zal aangaan met de
antibinding van een SP3 orbital aan het andere C-atoom (zie afbeelding). Blijkbaar heeft elke
SP3-orbitaal een SP3-antiorbitaal. Per sigmabinding tussen het C-atoom en de bijbehorende
H-atomen (3 in dit geval dus), zal er dus ook een antibinding zijn (ook 3 dus).
Gauche interactie
Een gauche interactie is een interactie waarbij twee moleculen in elkaars vanderwaalsstraal
komen. Dit is energetisch ongunstig en komt voor bij eclipsed conformaties.
15
Samenvatting Moleculen en Reactiviteit
Niek Groot
Conformaties van butaan
Net zoals bij ethaan, bestaat er bij butaan ook een staggered en een eclpised conformatie. Ook
deze zijn weer te geven in een Newmanprojectie. Je moet nu begrijpen dat een anti orbitaal
energetisch gunstig is en vaak een staggered conformatie tot gevolg heeft.
Cyclohexaan
Dat cyclohexaan misschien geen vlak molecule zou kunnen zijn is een idee dat al in 1890
voor het eerst werd verwoord. In dat jaar beschreef een 28-jarige onderzoeksassistent uit
Berlijn, Hermann Sachse, instructies over het vouwen van een stuk papier om de twee
vormen van cyclohexaan weer te geven. In zijn bewoordingen ging het over symmetrisch en
asymmetrisch cyclohexaan (de huidige termen zijn stoel en boot). Uit zijn beschrijving blijkt
duidelijk dat hij begreep dat er in cyclohexaan twee soorten waterstofatomen zijn, wij zeggen
nu axiaal en equatoriaal. In de koolstofchemie vormen de sp3-hybridorbitalen de basis voor
de structuur van verzadigde moleculen. De hoek tussen de orbitalen, en daarmee de
bindingshoek, op een koolstofatoom gebonden aan vier andere atomen is daarmee vastgelegd
16
Samenvatting Moleculen en Reactiviteit
Niek Groot
op 109,5 o. Dat geldt zowel voor de hoeken tussen de bindingen naar de andere
koolstofatomen als voor de bindingshoeken naar de waterstofatomen. Een vlakke structuur is
voor cyclohexaan dan ook niet mogelijk, de hoeken tussen de koolstofatomen zouden dan
120° moeten zijn. Door deze conformatie aan te nemen is cyclohexaan één van de weinige
ringvormige verbindingen die geen ringspanning kent. In laagste energietoestand van de
stoelvorm bevinden 6 van de 12 waterstofatomen zich in een axiale positie (de in figuur 1
rood gekleurde waterstofatomen) — de C-H-bindingen zijn parallel en steken naar onder en
boven uit de ringstructuur. De andere 6 staan in een equatoriale positie (de blauwe
waterstofatomen) — zij wijzen vanuit de omtrek van de ring naar buiten. Daarnaast geldt dat
op elk koolstofatoom één waterstofatoom ten opzichte van de ander naar "boven" staat (of in
ieder geval meer naar boven), en de ander dus naar beneden. Langs de ring gaand is te zien
dat de naar boven staande axiale positie (H1 in de linker structuur in figuur 2) afgewisseld
wordt met de enigszins naar boven staande equatoriale positie (H2). Ook is te zien dat de
axiale posities steeds van kant wisselen van koolstofatoom naar koolstofatoom (H1 axiaalomhoog gevolgd door H4 axiaal-omlaag). De equatoriale posities wisselen op gelijksoortige
wijze (H2 equatoriaal-omhoog, dan H3 equatorial-omlaag). Voor twee substituenten op
koolstofatomen direct naast elkaar in de ring zal voor een trans-1,2-cyclohexane gelden dat
beide substituenten axiaal of juist alle twee equatoriaal moeten staan om de trans-relatie (aan
weerskanten van het vlak van de
ring) waar te maken. Om dezelfde
reden zal in een cis-1,2cyclohexaan, de ene substituent
axiaal moeten staan en de andere
juist equatoriaal of omgekeerd. Ook
voor de andere structurele isomeren
gelden gelijksoortige regels ten aanzien
van hun relatieve geometrische posities.
In een proces dat ringinversie genoemd
wordt, kan de conformatie van de ring
wijzigen. Het gevolg is dat de axiale
waterstofatomen equatoriaal komen te
staan, en andersom. Dit proces wordt
ook het omklappen genoemd. Hoewel
axiaal en equatoriaal per
waterstofatoom wisselen, blijven de naar boven staande waterstofatomen naar boven staan,
en de naar onder gerichte waterstofatomen naar beneden. De twee stoelconformaties kunnen,
afhankelijk van de substituenten, verschillen in stabiliteit. Voor de meeste substituenten geldt
dat ze een stabielere conformatie opleveren als ze in de equatoriale positie voorkomen. Zo
wordt voorkomen dat er 1,3-diaxiale interacties optreden tussen de axiale substituenten op de
verschillende koolstofatomen in de ring. Als op koolstofatoom 1 een methylgroep in de axiale
positie zit (een methylgroep, hoewel niet echt groot, is toch een stuk groter dan een
waterstofatoom), zal er interactie optreden (hun vanderwaalsstralen overlappen elkaar) tussen
de methylgroep en de waterstofatomen op koolstof 3 en 5.
17
Samenvatting Moleculen en Reactiviteit
Niek Groot
Toelichting figuur
Naast de stoelconformatiekan cyclohexaan ook voorkomen als halve stoel of gedraaide boot
Hoewel de bootvorm geen hoekspanning vertoont, is de energie wel hoger dan die van de
stoelvorm door sterische hindering van de twee axiale waterstofatomen op de koolstofatomen
1 en 4, soms aangeduid als vlaggenmast-interactie.
18
Samenvatting Moleculen en Reactiviteit
Niek Groot
Moleculen & Reactiviteit
16 februari 2012
Z en E naamgeving
In de tegenwoordige scheikundige nomenclatuur wordt echter gebruikgemaakt van de Z/Eaanduiding. Hiertoe worden de atoomnummers van de eerstgebonden atomen aan de dubbele
binding met elkaar vergeleken. Indien de twee atomen met het hoogste atoomnummer aan
dezelfde zijde van de dubbele binding zitten, wordt gesproken van de Z-configuratie (van het
Duitse zusammen). In het andere geval is sprake van de E-configuratie (van het Duitse
entgegen). In ringsystemen wordt enkel gebruikgemaakt van de cis- en transnotatie. De Z/Eaanduiding is hier niet mogelijk omdat de atomen links en rechts van de dubbele binding
dezelfde massa hebben. Meestal kijkt men dan naar het volgende atoom in de reeks.
Regel 1: Hoe hoger het atoomnummer, hoe hoger
de prioriteit.
Regel 2: Als regel één niet voldoet moet je naar
het volgende atoom kijken
Regel 3: Dubbele bindingen worden behandeld
als een extra atoom. Hierbij mag je het atoom
na de dubbele binding nog een keer extra aan
het atoom na de dubbele binding denken.
Regel 4: Als het dan NOG niet lukt, moet je
kijken naar het massanummer van de
verschillende atomen (denk deuterium en
waterstof).
Nucleofiel
Een nucleofiel deeltje is een negatief ion of het
negatieve deel van een dipool-molecuul, met een
niet-bindend of vrij elektronenpaar dat makkelijk
kan reageren met een elektrofiel deeltje. Het deeltje
fungeert meestal als elektronenpaardonor (Lewis-base)
tov. een elektrofiel deeltje (Lewis-zuur).
Elektrofiel
Een elektrofiel deeltje is een positief geladen ion of het
positieve deel van een molecuul met een dipool. Deze kunnen reageren met een elektronrijk
centrum (nucleofiel deel) in een ander molecuul. Het elektrofiel deeltje fungeert meestal als
elektronenpaaracceptor (Lewis-zuur) t.o.v. een nucleofiel deeltje.
19
Samenvatting Moleculen en Reactiviteit
Niek Groot
Elektrofiele additie
Een additiereactie is een
chemische reactie waarbij uit
twee moleculen één nieuw
molecuul wordt gevormd: er
wordt een π-binding vervangen
door twee σ-bindingen. Het
substraat van een additiereactie
moet een dubbele of een
drievoudige binding bezitten.
Een elektrofiele additie is een
additie waarbij in stap 1 een elektrofiel deeltje H+ een covalente binding vormt met een
atoom van de elektronenrijke onverzadigde C=C binding: In stap 2 van de elektrofiele additie
ontstaat een tweede covalente binding tussen het gevormde positief geladen tussenproduct en
een nucleofiel deeltje Br-. Zoals afgebeeld is het nucleofiele deeltje gewoonlijk een anion; het
kan echter ook een neutraal molecuul zijn. Bij alle asymmetrische addities is regioselectiviteit
van belang. Regioselectiviteit wordt vaak bepaald door de Regel van Markovnikov.
“In de additie van een verbinding H-X aan een alkeen zal het waterstofatoom gebonden
worden aan het koolstofatoom dat al de meeste waterstofatomen heeft, de groep X zal
gebonden worden aan het koolstofatoom met de minste waterstofatomen.”
Het gebruik van pijlen
Er zijn regels voor het gebruik van pijlen in de organische chemie. In de DIA’s werden 4
regels genoemd, maar twee waren zo logisch, dat die ik die hierin weglaat.
Regel 1: Pijlen moeten altijd in de richting van twee elektronen worden getekend
Regel 2: De pijl moet altijd van een elektronenbron afkomstig zijn.
20
Samenvatting Moleculen en Reactiviteit
Niek Groot
Entropie en enthalpie
Entropie is een belangrijk begrip in de thermodynamica. Het is op het fundamenteelste niveau
een maat voor de wanorde of de ontaarding in een systeem, of liever de waarschijnlijkheid,
als het aantal mogelijke moleculaire configuraties van een macroscopische toestand (in
termen van macroscopische grootheden druk, temperatuur, etc.) gedeeld door het totale aantal
mogelijke moleculaire configuraties.
Wanneer je iets verwarmt, voeg je energie in de vorm van warmte toe, waardoor de
kinetische energie (thermische energie) van een object toeneemt. Hierdoor zal het object
sneller gaan bewegen en zal de entropie toenemen.
Om een proces (bijvoorbeeld een chemische reactie) te laten verlopen, moet de entropie
toenemen. Voor de totale entropie verandering kunnen we de volgende formule opstellen:
ΔG = ΔH – T ΔS
Hierin is:
ΔG – de vrije energieverandering (kJ/mol)
ΔH – de verandering in de enthalpie
T – de temperatuur in Kelvin
ΔS – de totale entropie verandering
Berekenen van ΔG
Om
te kunnen berekenen, maken we gebruik van het feit dat
is aan
. Zoals ik hierboven al beschreven heb, is de
Hieruit kan je volgende formule afleiden:
[ ][ ]
[ ][ ]
in evenwicht gelijk
bij een evenwicht gelijk aan 0.
Met deze formule kun je de
van een reactie uitrekenen. Begrijp ook dat wanneer de Keq
verandert, de waarde van
ook verandert. Wanneer reactant B reageert tot product C, kun
je aan de hand van de
bepalen of er meer van reactant B of product C in de oplossing zit.
Wanneer er veel product ontstaat, zal de teller groter zijn, waardoor de Keq een grotere
waarde krijgt en de
kleiner wordt.
21
Samenvatting Moleculen en Reactiviteit
Niek Groot
Exergonische en endergonische reacties
An exergonic reaction is a chemical reaction where the change in the Gibbs free energy is
negative,indicating a spontaneous reaction. Endergonic reactions are not spontaneous. By
thermodynamic standards, positive work, a form of energy, is defined as moving from the
surroundings (the external region) to the system (the internal region). Thus, an endergonic
process, as contrasted with an exergonic process, is one wherein the system absorbs energy
from the surroundings. As a result, during an endergonic process, energy is put into the
system. An endergonic reaction is a chemical reaction that absorbs energy in the form of
work.
Transition state
The transition state of a chemical reaction is a particular configuration along the reaction
coordinate. It is defined as the state corresponding to the highest energy along this reaction
coordinate. At this point, assuming a perfectly irreversible reaction, colliding reactant
molecules will always go on to form products. It is often marked with the double dagger ‡
symbol. De
is dus de hoeveelheid energie die het molecuul nodig heeft om in een
transitietoestand te komen (zie afbeelding hieronder).
22
Samenvatting Moleculen en Reactiviteit
Niek Groot
Reactie intermediaren
A reaction intermediate or an intermediate is a molecular entity that is formed from the
reactants (or preceding intermediates) and reacts further to give the directly observed
products of a chemical reaction. Most chemical reactions are stepwise, that is they take more
than one elementary step to complete. An intermediate is the reaction product of each of these
steps, except for the last one, which forms the final product. Reactive intermediates are
usually short lived and are very seldom isolated. Also, owing to the short lifetime, they do not
remain in the product mixture.
For example, consider this hypothetical stepwise reaction:
A+B→C+D
The reaction includes these elementary steps:
A + B → X*
X* → C + D
The chemical species X* is an intermediate. Hetzelfde geldt wanneer er HBr aan een 2 buteen
oplossing word toegevoegd. Eerst zal het waterstofatoom hechten, zodat er op het andere
koolstofatoom een positieve lading ontstaat (er wordt een elektron van de dubbele binding
‘gestolen’, zodat één koolstofatoom positief geladen wordt). Pas daarna zal de bromide
kunnen hechten (tweede transition state).Ga ook na dat de
alleen invloed heeft op de
eerste transitietoestand en niet op de tweede!
23
Samenvatting Moleculen en Reactiviteit
Niek Groot
Verdieping Markovnikov
Zoals ik al eerder had genoemd zal het H-atoom aan het koolstofatoom met de meeste
waterstofatomen hechten (regel van Markovnikov). Dit komt omdat een koolstofatoom met
gebonden waterstofatomen een minder goed carbocation is dan een koolstofatoom met
restgroepen (bijvoorbeeld methylgroepen). Je kunt zeggen dat een tertiair carbocation (3
gebonden restgroepen) een stabieler carbocation is dan een primair carbocation (één
restgroep).
Additie van water aan een alkeen
The addition of water to an alkene in the presence of a catalytic amount of strong acid leads
to the formation of alcohols (hydroxy-alkanes). This reaction proceeds via a standard
carbocation mechanism and follows the Markovnikov rule. The mechanism for the addition
of water to ethene follows. The hydrogen ion is attracted to the π bond, which breaks to form
a σ bond with one of the double-bonded carbons. The second carbon of the original doublebonded carbons becomes a carbocation. An acid-base reaction occurs between the water
molecule and the carbocation, forming an oxonium ion. The oxonium ion stabilizes by losing
a hydrogen ion, with the resulting formation of an alcohol.
24
Samenvatting Moleculen en Reactiviteit
Niek Groot
1,2-hydride shift
A 1,2-rearrangement or 1,2-migration is an organic reaction where a substituent moves from
one atom to another atom in a chemical compound. In a 1,2 shift the movement involves two
adjacent atoms but moves over larger distances are possible.
Ditzelfde geintje kun je uithalen met een methylgroep i.p.v. een waterstofatoom. Wanneer dit
gebeurt noemen we dat een 1,2-methyl shift. Je moet wel even onthouden dat de 1 en de 2 in
de naam 1,2-hydride/methyl shift niks te maken heeft met de naamgeving van het molecuul.
De 1 en de 2 geven alleen aan hoever een bepaalde groep shift. Wanneer deze shift niet
plaatsvindt, komt dat simpelweg omdat het carbocation niet stabiel genoeg is.
Note to self: vraag in het vragenuurtje of je dit een anti-markovnikovreactie kunt noemen.
25
Samenvatting Moleculen en Reactiviteit
Niek Groot
Halogeen alkeen additie
The reaction mechanism for an alkene bromination can be described as follows. In the first
step of the reaction, a bromine molecule approaches the electron-rich alkene carbon–carbon
double bond. The bromine atom closer to the bond takes on a partial positive charge as its
electrons are repelled by the electrons of the double bond. The atom is electrophilic at this
time and is attacked by the pi electrons of the alkene [carbon–carbon double bond]. It forms
for an instant a single sigma bond to both of the carbon atoms involved. The bonding of
bromine is special in this intermediate, due to its relatively large size compared to carbon, the
bromide ion is capable to interacting with both carbons which once shared the π-bond,
making a three-membered ring. The bromide ion acquires a positive formal charge. At this
moment the halogen ion is called a "bromonium ion" or "chloronium ion", respectively.
When the first bromine atom attacks the carbon–carbon pi-bond, it leaves behind one of its
electrons with the other bromine that it was bonded to in Br2. That other atom is now a
negative bromide anion and is attracted to the slight positive charge on the carbon atoms. It is
blocked from nucleophilic attack on one side of the carbon chain by the first bromine atom
and can only attack on the other side. As it attacks and forms a bond with one of the carbons,
the bond between the first bromine atom and the other carbon atoms breaks, leaving each
carbon atom with a halogen substituent.
Hydroboreringreactie
De hydroborering-oxidatiereactie, ook wel oxidatieve hydroborering genoemd, is een
tweestaps organische reactie die een alkeen omzet in een alcohol door de additie van water
over de dubbele binding, met boraan als elektrofiel. De hydroborering-oxidatiereactie is een
anti-Markovnikov-reactie, waarbij de hydroxylgroep op het minst gesubstitueerde
koolstofatoom van de dubbele binding wordt geplaatst. Hierin staat THF voor
tetrahydrofuraan, het oplosmiddel waarop boraan stabiel bewaard kan worden. Belangrijk in
de reactie is het gebruik van boraan, dat fungeert als elektrofiel in de reactie. De reden
hiervoor is dat het booratoom in de molecule slechts zes elektronen in zijn buitenste schil
heeft, terwijl acht het meest stabiel is (octetregel). Dit tekort maakt boraan een reactieve,
instabiele molecule.
26
Samenvatting Moleculen en Reactiviteit
Niek Groot
Werking van de hydroboreringreactie
Hydroborering is een proces van twee stappen,
namelijk de trialkylboraan formatie en de
waterstofperoxide en basebehandeling.
In the first step, borane (BH3) adds to the
double bond, transferring one hydrogen from
itself to the adjacent carbon. This reaction,
hydroboration is repeated two additional times
so that three alkenes add to each BH3. The resulting trialkylborane is treated with hydrogen
peroxide in the second step. This process replaces the B-C bonds with HO-C bonds. In the
second hydroboration–oxidation step, the nucleophilic hydroperoxide anion attacks the boron
atom.
Voorbeelden (LET OP DE PLEK VAN DE OH-GROEP!):
27
Samenvatting Moleculen en Reactiviteit
Niek Groot
Moleculen & Reactiviteit
20 februari 2012
Asymmetrisch koolstofatoom
Een asymmetrisch koolstofatoom is in de
organische chemie een koolstofatoom in een
organische verbinding die vier verschillende
groepen draagt. De vier groepen kunnen in
twee configuraties rond het koolstofatoom
worden aangebracht die elkaars spiegelbeeld
zijn. De twee mogelijke moleculen die zo
worden gemaakt zijn stereo-isomeren. Een
asymmetrisch koolstofatoom is een vorm
van chiraal centrum.
Veel verbindingen met asymmetrische koolstofatomen zijn optisch actief, dat wil zeggen dat
ze in oplossing een draaiing van gepolariseerd licht veroorzaken. Twee spiegelbeeldige
stereo-isomeren hebben de tegengestelde optische activiteit.
Per asymmetrisch koolstofatoom wordt het aantal stereo-isomeren van een verbinding
gewoonlijk verdubbeld. Twee aan twee zijn deze verbindingen elkaars spiegelbeeld; deze
paren noemt men enantiomeren.Een mengsel van gelijke hoeveelheden van twee
verbindingen die elkaars spiegelbeeld zijn (enantiomeren), wordt een racemisch mengsel of
racemaat genoemd. Stereo-isomeren van sommige verbindingen kunnen ook bij
kamertemperatuur vanzelf in elkaar overgaan. Dit wordt racemiseren genoemd.Een stof met
meerdere asymmetrische koolstofatomen, kan een stereo-isomeer hebben, dat gelijk is aan
zijn spiegelbeeld. Dat heet een mesovorm, een verbinding die gelijk is aan zijn eigen
spiegelbeeld en waarbij twee asymmetrische koolstofatomen chemisch identiek zijn
geworden.
R en S aanduiding
De letters zijn afkortingen van de
Latijnse woorden Rectus (rechts) en
Sinister (links). Om vast te stellen of
een enantiomeer R- of S- is, wordt aan
elke groep die aan het asymmetrisch
atoom verbonden is een prioriteit
toegekend. Deze prioriteit is gebaseerd
op het atoomnummer. Als er meerdere gelijke atomen zijn, worden de atomen verderop in de
functionele groep bepalend. Vervolgens wordt in gedachten de groep met de laagste prioriteit
naar achteren gedraaid, en een rondje gemaakt langs de overige groepen van lage naar hoge
prioriteit (je mag nummer 3 nooit overslaan!). Als dit rondje rechtsom gaat, is de stof R,
anders is de stof S. Om dit makkelijker te maken legde de docent het volgende trucje uit: Je
kan denkbeeldig twee atomen ‘omdraaien’ om zo het atoom met de laagste prioriteit achter te
krijgen. Vervolgens ga je elke prioriteit langs (1 t.m.t. 4), om na te gaan of het molecuul R of
S is. Is het S, dan zal het atoom (voor het verwisselen) R zijn geweest en vice versa.
28
Samenvatting Moleculen en Reactiviteit
Niek Groot
Specifieke rotatie
De specifieke rotatie is een stofeigenschap van een chemische verbinding die een
asymmetrisch koolstofatoom bezit. Omdat de specifieke rotatie ook afhankelijk is van de
temperatuur, moet aangegeven worden bij welke temperatuur de specifieke rotatie is bepaald,
normaal is dat 25°C. De eenheid van de specifieke rotatie [α]D is °.cm2 / g, maar meestal
wordt alleen de graad geschreven. Een negatieve waarde van [α]D betekent een
linksdraaiende rotatie en een positieve waarde rechtsdraaiende rotatie. De formule luidt als
volgt:
waarbij l de afstand is die het licht door de oplossing aflegt (in dm), c de concentratie (gram
per milliliter), dit alles bij de geven temperauur T en de golflengte λ. Indien gemeten wordt
aan een zuivere vloeistof, dan wordt de dichtheid van de vloeistof gebruikt in plaats van de
concentratie. Indien de stof een zeer grote specifieke rotatie heeft, of als de oplossing erg
geconcentreerd is, dan kan de werkelijke rotatie groter zijn dan 180°. Dit betekent dat, in
geval van één enkele meting met de polarimeter, deze draaiing niet wordt waargenomen,
eveneens draaiingen van 270°, 90°, 360°, 361° en 1°. In deze gevallen zal men de draaiing
bij verschillende concentraties moeten meten, om de specifieke rotatie te kunnen vaststellen.
Enantiomere overmaat
In de organische synthese is het bij het maken van grotere moleculen eerder regel dan
uitzondering dat er minstens één, maar vaak meer, koolstofatomen chiraal zijn: er bestaan
verschillende asymmetrische of chirale vormen van hetzelfde molecuul, zogenaamde
'enantiomeren'. Als een specifieke enantiomeer vereist is, kan soms door de keuze van de
juiste reagentia of condities de juiste configuratie rond zo'n koolstofatoom worden
vastgelegd. In het uiteindelijke product mag in veel gevallen slechts een van de twee
mogelijke vormen optreden. Om de mate van zuiverheid rond deze koolstofatomen te
beschrijven wordt de term enantiomere overmaat gebruikt. Er geldt de volgende formule:
Diastereomeer
Diastereomeren zijn stereo-isomeren die geen enantiomeer (spiegelbeelden) van elkaar zijn.
Twee stereo-isomeren zijn diastereomeren van elkaar als er één of meer chirale centra
verschillend zijn en ten minste één of meer andere chirale centra gelijk.
29
Samenvatting Moleculen en Reactiviteit
Niek Groot
Mesovormen
Een mesovorm of meso-isomeer is een
stereo-isomeer van een chemische stof
die niet optisch actief of chiraal is
hoewel deze wel over chirale centra
beschikt. Een mesovorm is
superponeerbaar (gelijk aan) met zijn
spiegelbeeld en bezit een symmetrievlak.
Een klassiek voorbeeld is wijnsteenzuur,
dit heeft twee asymmetrische
koolstofatomen en heeft dus maximaal
vier verschillende stereo-isomeren. Het
blijkt echter dat er in werkelijkheid maar
drie zijn: linksdraaiend (S,S)-(−)wijnsteenzuur, rechtsdraaiend (R,R)-(+)wijnsteenzuur en de niet-actieve
mesovorm die de (R,S)- of (S,R)configuratie heeft.
(R,S)- of (S,R)-wijnsteenzuur zijn equivalent omdat de twee asymmetrische centra en
dezelfde groepen gebonden zijn, wat maakt dat deze vorm gelijk is aan zijn spiegelbeeld en
een intern symmetrievlak bezit. De (R,R)- en (S,S)-varianten zijn wel spiegelbeelden
(enantiomeren) van elkaar, en zijn beiden diastereomeren van de mesovorm. Volgende figuur
toont de drie isomeren, en toont het spiegelvlak binnen meso-wijnsteenzuur.
30
Samenvatting Moleculen en Reactiviteit
Niek Groot
Moleculen & Reactiviteit
21 februari 2012
Reacties van chirale moleculen
No reaction at the asymmetric
center; both the reagent and the
product have the same relative
configuration:
If a reaction breaks a bond at the
asymmetric center, you need to
know the reaction mechanism in
order to predict the configuration
of the product:
Regioselectiviteit
In de organische chemie duidt regioselectiviteit op de voorkeur om te reageren op een
bepaalde plaats in een molecule.Het begrip is van toepassing bij tal van reacties, bijvoorbeeld
welk waterstofatoom door een sterke base kan worden geabstraheerd, of waar in de
benzeenring meerdere substituenten ten opzichte van elkaar geplaatst kunnen worden middels
een elektrofiele aromatische substitutie. Ook in reacties waarbij dubbele bindingen betrokken
zijn is vaak sprake van regioselectiviteit (regel van Markovnikov).
Stereospecifiteit
In de chemie duidt stereospecificiteit een stereochemische eigenschap van een
reactiemechanisme aan, waarbij verschillende stereoisomere producten gevormd worden
uitgaande van verschillende stereoisomere uitgangsstoffen of waarbij slechts één (of een
beperkt aantal) van de stereoisomeren reageert. Het verwante begrip, stereoselectiviteit,
beschrijft de eigenschap van een (mengsel van) reactanten om via een in principe nietstereospecifiek reactiemechanisme, maar onder invloed van andere factoren (bijvoorbeeld
sterische hindering) aanleiding geeft tot een bepaald sterische voorkeur in het gevormde
product. Het leidt dus niet - in tegenstelling tot stereospecificiteit - tot één welbepaald
isomeer product, maar tot een mengsel van enantiomeren, waarvan de voordeligste geometrie
het meest gevormd wordt.
31
Samenvatting Moleculen en Reactiviteit
Niek Groot
Syn en Anti nomenclature
Syn addition is the addition of two substituents to
the same side (or face) of a double bond or triple
bond, resulting in a decrease in bond order but an
increase in number of substituents. Generally the
substrate will be an alkene or alkyne. Anti addition
is in direct contrast to syn addition. In anti addition,
two substituents are added to opposite sides (or faces) of a double bond or triple bond, once
again resulting in a decrease in bond order but an increase in number of substituents. The
classical example of this is bromination (any halogenation) of alkenes. In de afbeelding
hieronder kun je zien dat een hydroboratie-oxidatiereactie altijd volgens een syn-additie
reageert. Je kunt hier dus van een stereoselectieve reactie spreken.
In tegenstelling tot een hydroborering-oxidatiereactie is een Br2 additiereactie een anti-additie
i.p.v. een syn-additie.
32
Samenvatting Moleculen en Reactiviteit
Niek Groot
Type reactie
Br2 met CH2Cl2 als oplosmiddel
Br2 met H2O (hydrolysering)
Hydroboratie-oxidatiereactie (met OH-, H2O2
en H2O)
Syn/anti
Anti
Anti
Syn
Gelokaliseerde elektronen
Een gedelokaliseerd elektron is een
elektron in een molecuul of een vaste
stof dat niet bij een specifiek atoom of
een specifieke covalente binding hoort,
maar is "uitgesmeerd" over het molecuul.
Dit verschijnsel noemt men delokalisatie.
Het bekendste voorbeeld van
delokalisatie is het benzeenmolecuul: de
zes elektronen die de bindingen tussen de C-atomen verzorgen, zijn gedelokaliseerd over de
gehele ring. Men geeft dit vaak grafisch weer door een cirkel in het midden van de zeshoek.
•
•
•
•
Has six identical carbon–carbon bonds
A planar molecule
Each pi electron is shared by all six carbons
The pi electrons are delocalized
33
Samenvatting Moleculen en Reactiviteit
Niek Groot
Resonance contributors
In chemistry, resonance is a way of describing delocalized electrons within certain molecules
or polyatomic ions where the bonding cannot be expressed by one single Lewis formula. A
molecule or ion with such delocalized electrons is represented by several contributing
structures. Each contributing structure can be represented by a Lewis structure, with only an
integer number of covalent bonds between each pair of atoms within the structure. Several
Lewis structures are used collectively to describe the actual molecular structure. However
these individual contributors cannot be observed in the actual resonance-stabilized molecule;
the molecule does not oscillate back and forth between the contributing structures, as might
be assumed from the word "resonance". The actual structure is an approximate intermediate
between the canonical forms, but its overall energy is lower than each of the contributors.
This intermediate form between different contributing structures is called a resonance hybrid.
Regels
1. Only electrons move (KUNNEN NIET LANGS SP3!)
2. Only p electrons and lone-pair electrons move
3. The total number of electrons in the molecule does not change
4. Charge of molecule remains the same
34
Samenvatting Moleculen en Reactiviteit
Niek Groot
Geconjugeerde dienen
Dienes have two or more carbon-carbon double bonds which may be either isolated (R'-C=CCH2-C=C-R') or conjugated (R-C=C-C=C-R). Each state represents a different stability due
to electron delocalization, and the conjugated form is generally favored in organic molecules.
Isolated dienes
Isolated dienes typically show no "special" stability. Their two π-bonds interact independent
of one another and they compete as intermolecular reaction sites depending on steric, kinetic,
and thermodynamic factors. Often, these types of dienes can be treated merely as larger, more
complex alkenes, because the two bonds cannot be said to have "communication" (proximal
electron delocalization due to location).
Conjugated dienes
Conjugated dienes are dienes which have at least two double bonds separated by a single
carbon-carbon bond, and for this reason conjugated dienes are observed to have a special
stability due to the overlap of electron orbitals. The areas of concentration of negative charge
(electron density) overlap across the three bonds (two double bonds and one single bond)
forming what behaves essentially as a single, continuous π-bond across three carbon atoms.
This delocalization of electron density stabilizes the molecule, resulting in the arrangement of
lowest energy (zie afbeelding hieronder).
35
Samenvatting Moleculen en Reactiviteit
Niek Groot
Bindingslengte
Als we kijken naar de reeks C-C, C=C en C≡C, dan is merkbaar dat de bindingslengte
afneemt met stijgend aantal bindingen tussen de koolstofatomen.
Resonantie-gestabiliseerde kationen
In het college werd verteld dat sommige kationen stabieler kunnen zijn dan een secundair of
tertiair carbokation. Voorbeelden hiervan zijn het allyl kation en het benzyl kation. Wanneer
er niet genoeg elektrofiele reagens is, zal alleen de meest reactieve dubbele binding reageren.
36
Samenvatting Moleculen en Reactiviteit
Niek Groot
1,2 en 1,4-additiereacties
Both isolated and conjugated dienes undergo electrophilic addition reactions. In the case of
isolated dienes, the reaction proceeds in a manner identical to alkene electrophilic addition.
The addition of hydrogen bromide to 1,4-pentadiene leads to two products. This reaction
follows the standard carbocation mechanism for addition across a double bond. The addition
of more hydrogen bromide results in addition across the second double bond in the molecule.
In the case of conjugated dienes, a 1,4-addition product forms in addition to the Markovnikov
and anti-Markovnikov products. Thus, in the addition of hydrogen bromide to 1,3-butadiene,
the following occurs. The 1,4-addition product is the result of the formation of a stable allylic
carbocation. When other electrophiles are added to conjugated dienes, 1,4 addition also
occurs. Many reactants, such as halogens, halogen acids, and water, can form 1,4-addition
products with conjugated dienes. Whether more 1,2 addition or 1,4 addition product is
created depends largely on the temperature at which the reaction is run. For example, the
addition of hydrogen bromide to 1,3-butadiene at temperatures below zero leads mainly to the
1,2-addition product, while addition reactions run at temperatures above 50°C with these
chemicals produces mainly the 1,4-addition product. If the reaction is initially run at 0°C and
then warmed to 50°C or higher and held there for a period of time, the major product will be
a 1,4 addition. These results indicate that the reaction proceeds along two distinct pathways.
At high temperatures, the reaction is thermodynamically controlled, while at low
temperatures, the reaction is kinetically controlled.
Geïsoleerde dienen zullen alleen 1,2-addities ondergaan
Geconjugeerde dienen zullen zowel 1,2-addities als 1,4-addities ondergaan (let wel op
dat de dubbele binding bij een 1,4 additie naar het midden verschuift!)
*NOTE TO SELF: Vragen om extra uitleg 1,4-addities en 1,2-addities.
37
Samenvatting Moleculen en Reactiviteit
Niek Groot
Waarom 1,4-addities stabieler zijn dan 1,2-addities
The 1,4-addition product is the result of the formation of a stable allylic carbocation.It is very
stable because the charge on the primary carbon is delocalized along the carbon chain by
movement of the π electrons in the π bond (allylic cation). This delocalization of charge by
electron movement is called resonance, and the various intermediate structures are called
resonance structures. However, according to resonance theory, none of the intermediate
resonance structures are correct. The true structure is a hybrid of all the structures that can be
drawn. The hybrid structure contains less energy and is thus more stable than any of the
resonance structures. The more resonance structures that can be drawn for a given molecule,
the more stable it is. The difference in energy between the calculated energy content of a
resonance structure and the actual energy content of the hybrid structure is called the
resonance energy, conjugation energy, or delocalization energy of the molecule. The allylic
carbocation exists as a hybrid of two resonance structures. Because it is resonance stabilized,
the allylic carbocation is much more stable than an ordinary primary carbocation. Resonance
stability always leads to a more stable state than inductive stability.
Substitutiereacties
Een substitutiereactie is een chemische reactie waarin een atoom wordt vervangen door een
ander atoom(groep) Hierbij wordt een σ-binding doorbroken, en vervangen door een nieuwe
binding.
Nucleofiele substitutiereacties
Een nucleofiele substitutie is een type
substitutiereactie, waarbij een nucleofiel
deeltje aanvalt op een ander (elektronarm)
deeltje. Hierbij wordt een functionele groep
op een molecuul vervangen (vertrekkende
groep) door het nucleofiel. Een nucleofiel
deeltje moet altijd een sterkere base zijn als zijn de geëlimineerde groep, dit omdat bij een
afnemende base-sterkte ook de bindingssterkte afneemt. Over het algemeen kan gesteld
worden dat alle negatief geladen deeltjes, of groepen met een formeel of informeel negatief
geladen site, zich kunnen gedragen als nucleofiel.
38
Samenvatting Moleculen en Reactiviteit
Niek Groot
Sn2-reactie
Bij de SN2-reactie wordt de verbinding met de leaving group verbroken terwijl de binding
met de nucleofiel zich al aan het vormen is. De nucleofiel valt dan van achteren aan, omdat
daar nog een leeg orbitaal zit. Als de leaving group eenmaal weg is, treedt inversie van de
geometrie op. Doordat de nucleofiel van achteren aanvalt zitten de andere bindingen in het
begin erg dicht bij het nucleofiel, wat tot sterische hindering leidt. Daardoor klapt de
molecule als het ware om.
Een SN2-reactie komt vooral voor bij primaire substraten. Wanneer er meerdere R-groepen
aanwezig zijn hinderen zij de aanval van het nucleofiel. Er is dan sprake sterische hindering
(zie afbeelding hieronder)
Substraat
Like the substrate, steric hindrance affects the nucleophile's strength. The methoxide anion,
for example, is both a strong base and nucleophile because it is a methyl nucleophile, and is
thus very much unhindered. tert-Butoxide, on the other hand, is a strong base, but a poor
nucleophile, because of its three methyl groups hindering its approach to the carbon.
Nucleophile strength is also affected by charge and electronegativity: nucleophilicity
increases with increasing negative charge and decreasing electronegativity.
39
Samenvatting Moleculen en Reactiviteit
Niek Groot
For example, OH- is a better nucleophile
than water, and I- is a better nucleophile
than Br- (in polar protic solvents). In a polar
aprotic solvent, nucleophilicity increases up
a column of the periodic table as there is no
hydrogen bonding between the solvent and
nucleophile; in this case nucleophilicity
mirrors basicity. I- would therefore be a
weaker nucleophile than Br- because it is a
weaker base. Het komt er dus op neer dat
een zwakke base een goede leaving group
is. I.t.t. zwakke basen zijn sterke basen juist
goede nucleofielen (aanvallers).
Sn1 reactie
De SN1-reactie is een reactiemechanisme in de scheikunde. Hierbij wordt de leaving group,
een deel van een substraatmolecuul, vervangen door een nucleofiel deeltje. De naam SN1
staat voor een substitutie door een nucleofiel deeltje in een monomoleculaire
snelheidsbepalende stap. Dit houdt in dat bij de snelheidsbepalende (langzaamste) stap in het
mechanisme één deeltje betrokken is. Dat ene deeltje is bij SN1 het substraatmolecuul; de
snelheid van de reactie wordt bepaald door de snelheid van de afsplitsing van de leaving
group. In de eerste stap wordt het substraat gesplitst in een carbokation en de leaving group,
bromide in dit voorbeeld. Vervolgens reageert het carbokation met een nucleofiel deeltje, in
dit voorbeeld jodide. Het mechanisme van de reactie werd ontrafeld met behulp van metingen
van reactiesnelheden (de reactiekinetiek) en de stereochemie. In het algemeen zijn
carbokationen zo instabiel dat ze zeer snel met een nucleofiel deeltje zullen reageren..
Daardoor is de eerste stap, de splitsing van het substraat in carbokation en leaving group, in
de regel snelheidsbepalend. Een ander reactiemechanisme dat qua naamgeving lijkt op het
hierboven beschreven mechanisme, is de SN2-reactie. Dit is een nucleofiele substitutie
waarbij de snelheidsbepalende stap bimoleculair is (in de transition state).
40
Samenvatting Moleculen en Reactiviteit
Niek Groot
Belangrijke punten
Het is belangrijk om te onthouden dat er bij een SN2 reactie, altijd één product ontstaat die de
tegenovergestelde structuur van het oorspronkelijke alkylhalide heeft (dus R i.p.v. S of vice
versa). Om dit even goed te begrijpen moet je even opgaven 22 en 25 van blz. 346 en 358 van
het boek maken. Bij een SN1 reactie, ontstaan er altijd twee enantiomeren, namelijk de R en
de S configuratie. Let hierbij ook even op de oriëntatie van de zijgroepen (vraag 25c). Als je
je afvraagt of je nou met een SN1 of een SN2 reactie te maken hebt moet je deze vuistregel
aanhouden:
Een SN2 reactie treedt op bij een hoge concentratie van een goede nucleofiel (sterke
base NH3 of CH3O-)
Een SN1 reactie treedt op bij de aanwezigheid van een slechte nucleofiel (zuur of
zwakke base CH3OH).
Soort oplosmiddel
Wanneer je een reactie hebt tussen een reagens en een geladen nucleofiel, zal de
aanwezigheid van een polair oplosmiddel er voor zorgen dat de reactie langzamer zal
verlopen. The solvent affects the rate of reaction because solvents may or may not surround a
nucleophile, thus hindering or not hindering its approach to the carbon atom (maak vraag 45
blz 372). Increasing the polartity of the solvent will decrease the rate of the reaction if one or
more reactants in the rate-determining step are charged and will increase the rate of the
reaction if none of the reactants in the rate-determining step is charged. The greater or more
concentrated the charge on a molecule, the stronger will be its interactions with a polar
solvent and the more the charge will be stabilized (blz 363 boek).
41
Samenvatting Moleculen en Reactiviteit
Niek Groot
Moleculen & Reactiviteit
24 februari 2012
Nucleofiele acylsubstitutie
De reactie van een nucleofiel met de polaire carbonylgroep van bijvoorbeeld een aldehyde of
keton resulteert in een nucleofiele additie met een tetraëdrisch alkoxide als primair
reactieproduct. Bij acylverbindingen echter is het carbonyl-koolstofatoom gebonden aan een
substituent dat kan fungeren als leaving group. Door de nucleofiele aanval op de
carbonylgroep ontstaat een tijdelijk tetraëdrisch intermediair, waarbij zuurstof een negatieve
lading verkrijgt (een zogenaamd alkoxide). De carbonylgroep, die een thermodynamisch en
elektronisch gunstig functionele groep is, zal zich hervormen. Hierbij kunnen twee dingen
plaatsgrijpen: het nucleofiel wordt weer afgesplitst of de leaving group wordt afgesplitst. In
het geval van koolstofnucleofielen (carbanionen), zal steeds de leaving group afgesplitst
worden, omdat een koolstof-koolstofbinding zeer sterk is. In het geval van zuurstof- of
stikstofnucleofielen treedt er doorgaans een evenwicht op tussen het oorspronkelijke en het
substitutieproduct, en kan het evenwicht naar het eindproduct worden verlegd door
bijvoorbeeld een overmaat van het nucleofiel te gebruiken.
Wanneer verloopt deze reactie
Z- zal worden verdrongen wanneer deze een (veel) zwakkere base is dan Y-. Het omgekeerde
geldt ook: Y-zal worden verdrongen wanneer deze een zwakkere base is dan Z-. Wanneer
men een sterk basische nucleofiel toevoegt aan een carbonyl compoud met een zwak basische
Y groep, zal de Y worden vervangen door de sterke base. Vaak worden acylchloride en
acylbromide gebruikt voor dit soort reacties. Als het goed is kan je nu beredeneren waarom.
42
Samenvatting Moleculen en Reactiviteit
Niek Groot
Een sterke base vindt het niet erg om ‘alleen’ in een oplossing te zitten, omdat hij snel
geprotoneerd zal worden. Omdat het centrale koolstofatoom positief geladen wordt (delta
plus), zal deze meer elektrofiel worden dan voorheen. Je kunt je dus voorstellen dat het
protoneren van het carbonylmolecuul de afsplitsing en dus het vertrek van de leaving group
stimuleert (toevoegen H+ aan oplossing, bijvoorbeeld NH2 in NH3).
43
Samenvatting Moleculen en Reactiviteit
Niek Groot
Reacties
44
Samenvatting Moleculen en Reactiviteit
Niek Groot
Vorming van een carbonzuur en een ester uit een zure anhydride
45












