Eindexamen scheikunde 1-2 VWO 2001 - II
havovwo.nl
■■■■
Thiocyanaat in speeksel
Bij de behandeling van iemand met een cyanidevergiftiging worden de cyanide-ionen
(CN-) in de lever omgezet tot thiocyanaationen (SCN-). De thiocyanaationen komen
onder andere in het speeksel terecht. De hoeveelheid thiocyanaat in het speeksel is een
maat voor de hoeveelheid cyanide die nog in het lichaam aanwezig is.
De concentratie thiocyanaat in het speeksel kan colorimetrisch bepaald worden. Door
toevoeging van een oplossing met Fe3+ ionen aan het speeksel vormen zich FeSCN2+ ionen,
die er de oorzaak van zijn dat de oplossing een rode kleur krijgt.
De vorming van FeSCN2+ is een evenwichtsreactie:
2+
Fe3+(aq) + SCN-(aq) ¬
® FeSCN (aq)
Voor dit evenwicht geldt: K = 9,1×102 (298 K).
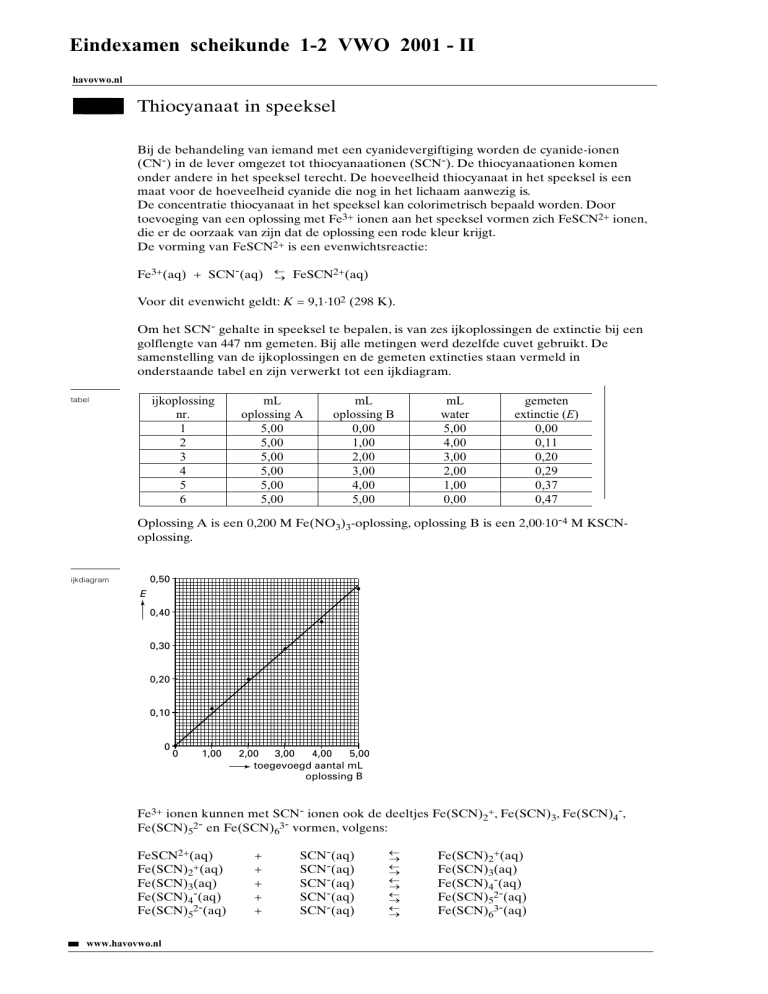
Om het SCN- gehalte in speeksel te bepalen, is van zes ijkoplossingen de extinctie bij een
golflengte van 447 nm gemeten. Bij alle metingen werd dezelfde cuvet gebruikt. De
samenstelling van de ijkoplossingen en de gemeten extincties staan vermeld in
onderstaande tabel en zijn verwerkt tot een ijkdiagram.
ijkoplossing
nr.
1
2
3
4
5
6
tabel
mL
oplossing A
5,00
5,00
5,00
5,00
5,00
5,00
mL
oplossing B
0,00
1,00
2,00
3,00
4,00
5,00
mL
water
5,00
4,00
3,00
2,00
1,00
0,00
gemeten
extinctie (-)
0,00
0,11
0,20
0,29
0,37
0,47
Oplossing A is een 0,200 M Fe(NO3)3-oplossing, oplossing B is een 2,00×10-4 M KSCNoplossing.
0,50
ijkdiagram
E
0,40
0,30
0,20
0,10
0
0
1,00
2,00
3,00
4,00
5,00
toegevoegd aantal mL
oplossing B
Fe3+ ionen kunnen met SCN- ionen ook de deeltjes Fe(SCN)2+, Fe(SCN)3, Fe(SCN)4-,
Fe(SCN)52- en Fe(SCN)63- vormen, volgens:
FeSCN2+(aq)
Fe(SCN)2+(aq)
Fe(SCN)3(aq)
Fe(SCN)4-(aq)
Fe(SCN)52-(aq)
www.havovwo.nl
+
+
+
+
+
SCN-(aq)
SCN-(aq)
SCN-(aq)
SCN-(aq)
SCN-(aq)
¬
®
¬
®
¬
®
¬
®
¬
®
Fe(SCN)2+(aq)
Fe(SCN)3(aq)
Fe(SCN)4-(aq)
Fe(SCN)52-(aq)
Fe(SCN)63-(aq)
Eindexamen scheikunde 1-2 VWO 2001 - II
havovwo.nl
Alle soorten deeltjes die uit Fe3+ en SCN- ionen gevormd kunnen worden, veroorzaken
een rode kleur. Het absorptiespectrum is voor iedere soort deeltjes anders. De vorming
van andere soorten deeltjes dan FeSCN2+ ionen moet daarom voor een nauwkeurige
bepaling worden tegengegaan. Dit wordt bereikt door de molariteit van oplossing A
1000 keer zo groot te maken als de molariteit van oplossing B.
2p
Leg aan de hand van een evenwichtsbeschouwing uit hoe een grote molariteit van
oplossing A ten opzichte van oplossing B ervoor kan zorgen dat de vorming van andere
soorten deeltjes dan Fe(SCN)2+ te verwaarlozen is.
8 ■
In de ijkoplossingen 2 tot en met 6 is meer dan 98% van de SCN- ionen omgezet tot
FeSCN2+ ionen. De vorming van andere soorten deeltjes dan FeSCN2+ in deze
oplossingen is te verwaarlozen.
4p
9 ■
2p
10 ■
Bereken de concentraties, in mol L-1, van de ionen Fe3+, SCN- en FeSCN2+ in
ijkoplossing 6 als 98% van de SCN- ionen is omgezet tot FeSCN2+.
Laat door een berekening van de concentratiebreuk zien dat in ijkoplossing 6 in de
evenwichtssituatie méér dan 98% van de SCN- ionen is omgezet tot FeSCN2+ (298 K).
•
•
•
•
•
4p
11 ■
Van een persoon werd speeksel verzameld. Het speeksel onderging de volgende
bewerkingen:
een hoeveelheid van het speeksel werd gedurende vijf minuten gecentrifugeerd;
van de heldere oplossing werd 0,100 mL gepipetteerd in een maatkolf van 10,00 mL;
aan de vloeistof werd 5,00 mL oplossing A toegevoegd;
met water werd de oplossing in de maatkolf aangevuld tot 10,00 mL;
van de zo ontstane oplossing werd, met dezelfde cuvet als die waarmee de extincties van
de ijkoplossingen waren bepaald, de extinctie bij 447 nm gemeten; deze was 0,23.
Bereken mede met behulp van het ijkdiagram de concentratie van de SCN- ionen,
in mol L-1, in het onderzochte speeksel.
www.havovwo.nl












