391
44 Aangeboren hartziekten
B.J.M. Mulder, M. Gewillig, P.G. Pieper, F.J. Meijboom, M. Witsenburg en J.P.M. Hamer
Inhoud
44.1
44.2
44.3
44.4
44.5
44.6
44.7
44.8
44.9
44.10
44.11
44.12
44.13
Inleiding 391
Etiologie, genetica en pathofysiologie 392
Atriumseptumdefect 393
Ventrikelseptumdefect 397
Atrioventriculair septumdefect 399
Persisterende ductus arteriosus (Botalli) 401
Eisenmengersyndroom 402
Coarctatio aortae 404
Pulmonalisstenose 406
Tetralogie van Fallot 407
Het univentriculaire hart en de fontancirculatie 409
Transpositie van de grote vaten 411
Congenitaal gecorrigeerde transpositie van de
grote vaten 413
44.14 Ebsteinmalformatie van de tricuspidalisklep 415
44.15 Marfansyndroom 416
44.16 Zwangerschap, partus en anticonceptie 417
Kernpunten 419
Literatuur 421
44.1 Inleiding
In dit hoofdstuk over aangeboren hartafwijkingen worden de
morfologie en fysiologie van veelvoorkomende aangeboren
hartafwijkingen besproken. Naast de diagnostiek en de vaak
chirurgische of interventionele behandeling van de afwijkingen,
wordt ook aandacht besteed aan de vooruitzichten en resultaten
op lange termijn. Harttransplantatie en prenatale echocardiografie worden niet besproken.
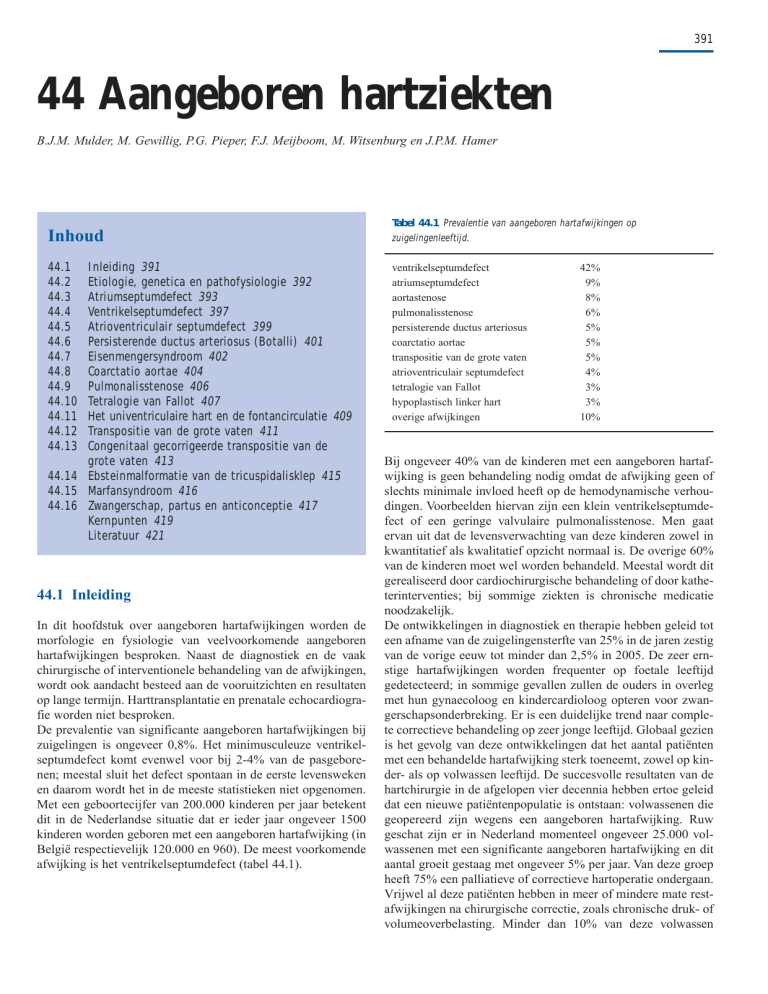
De prevalentie van significante aangeboren hartafwijkingen bij
zuigelingen is ongeveer 0,8%. Het minimusculeuze ventrikelseptumdefect komt evenwel voor bij 2-4% van de pasgeborenen; meestal sluit het defect spontaan in de eerste levensweken
en daarom wordt het in de meeste statistieken niet opgenomen.
Met een geboortecijfer van 200.000 kinderen per jaar betekent
dit in de Nederlandse situatie dat er ieder jaar ongeveer 1500
kinderen worden geboren met een aangeboren hartafwijking (in
België respectievelijk 120.000 en 960). De meest voorkomende
afwijking is het ventrikelseptumdefect (tabel 44.1).
Tabel 44.1 Prevalentie van aangeboren hartafwijkingen op
zuigelingenleeftijd.
ventrikelseptumdefect
atriumseptumdefect
aortastenose
pulmonalisstenose
persisterende ductus arteriosus
coarctatio aortae
transpositie van de grote vaten
atrioventriculair septumdefect
tetralogie van Fallot
hypoplastisch linker hart
overige afwijkingen
42%
9%
8%
6%
5%
5%
5%
4%
3%
3%
10%
Bij ongeveer 40% van de kinderen met een aangeboren hartafwijking is geen behandeling nodig omdat de afwijking geen of
slechts minimale invloed heeft op de hemodynamische verhoudingen. Voorbeelden hiervan zijn een klein ventrikelseptumdefect of een geringe valvulaire pulmonalisstenose. Men gaat
ervan uit dat de levensverwachting van deze kinderen zowel in
kwantitatief als kwalitatief opzicht normaal is. De overige 60%
van de kinderen moet wel worden behandeld. Meestal wordt dit
gerealiseerd door cardiochirurgische behandeling of door katheterinterventies; bij sommige ziekten is chronische medicatie
noodzakelijk.
De ontwikkelingen in diagnostiek en therapie hebben geleid tot
een afname van de zuigelingensterfte van 25% in de jaren zestig
van de vorige eeuw tot minder dan 2,5% in 2005. De zeer ernstige hartafwijkingen worden frequenter op foetale leeftijd
gedetecteerd; in sommige gevallen zullen de ouders in overleg
met hun gynaecoloog en kindercardioloog opteren voor zwangerschapsonderbreking. Er is een duidelijke trend naar complete correctieve behandeling op zeer jonge leeftijd. Globaal gezien
is het gevolg van deze ontwikkelingen dat het aantal patiënten
met een behandelde hartafwijking sterk toeneemt, zowel op kinder- als op volwassen leeftijd. De succesvolle resultaten van de
hartchirurgie in de afgelopen vier decennia hebben ertoe geleid
dat een nieuwe patiëntenpopulatie is ontstaan: volwassenen die
geopereerd zijn wegens een aangeboren hartafwijking. Ruw
geschat zijn er in Nederland momenteel ongeveer 25.000 volwassenen met een significante aangeboren hartafwijking en dit
aantal groeit gestaag met ongeveer 5% per jaar. Van deze groep
heeft 75% een palliatieve of correctieve hartoperatie ondergaan.
Vrijwel al deze patiënten hebben in meer of mindere mate restafwijkingen na chirurgische correctie, zoals chronische druk- of
volumeoverbelasting. Minder dan 10% van deze volwassen
392
populatie is wezenlijk gehandicapt, maar bij een substantieel
deel bestaat een aanzienlijke restmorbiditeit waarvoor specifieke zorg noodzakelijk is. Over de uitkomsten op lange termijn is
nog weinig bekend.
Enkele jaren geleden is in Nederland de landelijke registratie
CONCOR (CONgenitale CORvitia) opgezet, met het doel
onderzoek naar de langetermijnresultaten van verschillende
hartafwijkingen te faciliteren. Om het onderzoek naar de genetische achtergronden van de hartontwikkeling te bevorderen, is
een DNA-bank aan de CONCOR-registratie gekoppeld.
De meest voorkomende problemen bij volwassenen met een
(geopereerde) aangeboren hartafwijking zijn ritmestoornissen,
pompfalen (vaak van het rechter ventrikel), endocarditis, conduitobstructies, klepinsufficiënties en problemen ten gevolge van
pulmonale hypertensie.
Behalve over de cardiale problematiek wordt ook op andere terreinen advies gevraagd door patiënten, bijvoorbeeld over verzekeringen, zwangerschap, erfelijkheid, rijbewijs, beroepskeuze,
woning, anticonceptie en psychologische problemen rond hun
hartafwijking. Voor deze patiëntengroep is dus een multidisciplinaire aanpak noodzakelijk. Concentratie van de zorg voor
deze groep biedt de beste mogelijkheid voor het vergroten van
de specifieke expertise en kennis en daardoor voor een optimale patiëntenzorg. Daarnaast is een goede samenwerking met cardiologen in regionale ziekenhuizen onontbeerlijk voor de opvang
van acute complicaties (ritmestoornissen, decompensatio cordis), cardiologische consultatie bij niet-cardiale problematiek
(chirurgische ingrepen), (tussentijdse) poliklinische controles en
zorg in de terminale fase. Zowel voor een gespecialiseerd centrum als voor een regionaal ziekenhuis is een specifieke taak
weggelegd en taakverdeling en verantwoordelijkheden moeten
onderling op elkaar worden afgestemd.
Kennis van de morfologie, de fysiologie en het natuurlijke
beloop van aangeboren hartafwijkingen is onontbeerlijk voor de
begeleiding en behandeling van deze patiënten, op welke leeftijd dan ook. Daarnaast is inzicht in de verschillende behandelingstechnieken noodzakelijk, evenals inzicht in de mogelijke
complicaties die verbonden zijn aan de behandeling, zowel op
korte als lange termijn.
44.2 Etiologie, genetica en pathofysiologie
44.2.1 Etiologie
Het hart ontstaat tijdens de organogenese tussen de zesde en
tiende zwangerschapsweek. Grotendeels nog onvoldoende
opgehelderde moleculaire mechanismen sturen mesodermale
stamcellen aan tot de ontwikkeling in cardiomyocyten, die vervolgens geactiveerd worden door genen die verantwoordelijk
zijn voor contractiliteit en morfogenese.
De cardiomyocyten komen mediaan aan de ventrale zijde van
het embryo samen en vormen daar de primaire hartbuis. Kromming van de hartbuis naar rechts resulteert in een dorsaal gelegen atriale pool, ventraal gelegen ventrikels en een superior
gelegen arteriële pool. Vervolgens treedt septumvorming op,
DEEL G CONGENITALE HARTAFWIJKINGEN, PERICARDZIEKTEN EN TUMOREN
waarmee de linker en rechter harthelft worden gescheiden. Verstoring van dit proces leidt tot aangeboren afwijkingen van het
hart, waarin een grote variatie bestaat. Naast frequent voorkomende afwijkingen zoals septumdefecten en klepstenosen, kan
een verstoring in deze ontwikkeling ook leiden tot een abnormale oriëntatie en koppeling van de structuren, klepatresie en
onderontwikkeling van de ventrikels.
In slechts 10-20% van de gevallen is een oorzakelijke factor
voor het ontstaan van de hartafwijking aantoonbaar. Naast een
genetische oorzaak kan de afwijking ook een gevolg zijn van
teratogene factoren en intra-uteriene infecties.
44.2.2 Genetica
De oorzaken van aangeboren hartafwijkingen kunnen worden
ingedeeld in chromosomale, monogene (verandering in één
enkel gen = mutatie) en multifactoriële oorzaken.
Chromosomale afwijkingen (8-10%)
Bij een chromosomale afwijking is er dikwijls een numerieke
abnormaliteit van de chromosomen. Voorbeelden zijn trisomie13, -18 en -21 (downsyndroom). De diagnose turnersyndroom (in
40-60% van de gevallen door 45,X-karyotype veroorzaakt) wordt
dikwijls pas in de puberteit of op volwassen leeftijd gesteld. Ook
kan een klein deel van een chromosoom ontbreken (microdeletie).
De meest voorkomende microdeletie is 22q11.2, onder andere
geassocieerd met het digeorgesyndroom en het velocardiofaciaal
syndroom (VCFS). De cardiale afwijkingen bij deze deletie zijn
vooral uitstroomafwijkingen (onder andere tetralogie van Fallot).
Andere microdeleties zijn 20p12, leidend tot het alagillesyndroom, en 7q11, leidend tot het williamssyndroom.
Monogene afwijkingen (3-5%)
Bij deze afwijkingen bestaat er een substantiële kans op herhaling bij het nageslacht (50% bij autosomaal dominante aandoeningen). De ernst van de afwijkingen kan buitengewoon variabel zijn. Er zijn honderden syndromen bekend. Enkele van de
meest voorkomende autosomaal dominante aandoeningen zijn
het alagillesyndroom (20p12), het downsyndroom (trisomie21), het holt-oramsyndroom (12q24.1), het marfansyndroom
(15q21.1), het noonansyndroom (15q24) en het williamssyndroom (7q11.23). Geïsoleerde aangeboren hartafwijkingen worden steeds vaker in verband gebracht met monogene aandoeningen (in het bijzonder het atrioventriculair septumdefect (AVSD),
het atriumseptumdefect-II (ASD-II) en links obstructieve afwijkingen). Er zijn waarschijnlijk verschillende genen die een
AVSD kunnen veroorzaken (de aandoening is dus genetisch
heterogeen). Bij het familiair voorkomende ASD-II worden
mutaties gevonden in diverse genen. Bij 7-19% van eerstegraads
familieleden van patiënten met links obstructieve afwijkingen
(aortastenose, bicuspide aortaklep, coarctatio aortae en hypoplastisch linkerhart) worden hartafwijkingen gevonden.
Multifactoriële afwijkingen (85%)
Bij deze afwijkingen is sprake van een combinatie van genetische en exogene factoren. Voorbeelden van omgevingsfactoren
44
393
CONGENITALE HARTZIEKTEN
en teratogenen zijn alcohol, amfetaminen, anticonvulsiva,
maternale diabetes, geslachtshormonen, lithium, sommige
selectieve serotonineheropnameremmers, fenylketonurie, retinoïnezuur en maternale infecties.
Intra-uteriene infecties. Indien vroeg in de zwangerschap een
actieve rubella-infectie wordt doorgemaakt, is de kans op het
ontstaan van een hartafwijking bij de foetus ongeveer 40%. In
dat geval gaat het meestal om een specifiek complex van afwijkingen, namelijk een persisterende ductus arteriosus (Botalli) en
een perifere pulmonalistakstenose. Daarnaast kan de infectie
leiden tot microcefalie, binnenoordoofheid en mentale retardatie. Als gevolg van de enige jaren geleden ingevoerde routinevaccinatie tegen rubella bij meisjes is de prevalentie van het
rubellasyndroom nagenoeg verdwenen.
Ook infecties met andere virale verwekkers, zoals cytomegalievirus, coxsackie-B-virus en griepvirus, zijn in verband gebracht
met het ontstaan van aangeboren hartafwijkingen.
Bij multifactoriële afwijkingen is er bij alle eerstegraads familieleden een verhoogde prevalentie, die meestal enkele procenten bedraagt. Nakomelingen van vrouwen met een aangeboren
hartafwijking hebben vaker een dergelijke afwijking dan nakomelingen van mannen met een aangeboren hartafwijking.
Voorlichting
Voorlichting door een klinisch geneticus is geïndiceerd als
iemand vragen heeft over een aangeboren en/of erfelijke aandoening in de familie of bij hem- of haarzelf en als er vanwege de
familieanamnese (meer dan één aangedane persoon in een familie) het vermoeden bestaat dat de hartafwijking erfelijk zou kunnen zijn. Eventueel kan besloten worden tot afzien van nageslacht, aanvaarden van het herhalingsrisico, kiezen voor zwangerschap met donormateriaal of vormen van prenatale diagnostiek.
arteriële zuurstofspanning en een afname van circulerende prostaglandinen. Door het inzetten van de ademhaling en de toename van de longdoorbloeding stijgt de arteriële zuurstofspanning. Door het wegvallen van de placenta (grootste producent
van prostaglandinen) en een vijfvoudige toename van het longdebiet (grootste filter voor prostaglandinen) nemen de circulerende prostaglandinen af.
Bij het klieven van de navelstreng ontstaat een sterke toename
van de systeemvaatweerstand, en daarmee van de nabelasting
van het linker ventrikel. Tegelijkertijd neemt de zuurstofbehoefte van de pasgeborene sterk toe door onder andere de veranderde temperatuurregulatie, ademhaling en bovengenoemde factoren. Het hartminuutvolume zal dus direct na de geboorte sterk
moeten stijgen. Kort na de geboorte bestaat onder normale
omstandigheden dan ook weinig hartfunctiereserve. De hartfrequentie is hoog en de contractiliteit vrijwel maximaal.
De daling van de longvaatweerstand, die direct na de geboorte
begint, is een proces dat pas na ongeveer zes weken voltooid is.
Dit betekent dat de druk in het rechter ventrikel, die vanaf de
geboorte eenzelfde slagvolume opbrengt als het linker ventrikel,
aanvankelijk nog even hoog is als die in het linker ventrikel. Pas
na enkele dagen tot weken is die druk tot een ‘volwassen’ waarde gedaald.
Het verdwijnen van de shunts via het foramen ovale en de ductus arteriosus, de geringe functionele reserve en de geleidelijke
daling van de longvaatweerstand hebben gevolgen voor de
pathofysiologie, klinische presentatie en behandeling van de
meeste aangeboren hartafwijkingen. Dit wordt bij de afzonderlijke afwijkingen besproken.
44.3 Atriumseptumdefect
44.2.3 Pathofysiologie
44.3.1 Morfologie
Voor de geboorte is er een rechts-linksshunt door het foramen
ovale en een rechts-linksshunt door de ductus arteriosus. Het
rechter en linker ventrikel hebben dezelfde nabelasting omdat ze
beide het bloed naar de systeemcirculatie pompen. Het linker
ventrikel pompt het bloed direct naar de aorta ascendens. Het
rechter ventrikel pompt het bloed naar de arteria pulmonalis en
vervolgens via de wijde ductus arteriosus (Botalli) naar de aorta
descendens. Omdat prenataal de longvaatweerstand hoog is, zal
slechts een zeer klein deel (10%) van het door het rechter ventrikel uitgepompte bloed de longen passeren. De oxygenatie van
het bloed vindt uitsluitend in de placenta plaats en bereikt de
foetale circulatie in de vena cava inferior. Dit bloed bereikt het
linker hart preferentieel via het foramen ovale.
Direct na de geboorte daalt de longvaatweerstand, waardoor de
bloedstroom naar de longen toeneemt en daarmee ook de longveneuze terugvloed naar het linker atrium. Hierdoor stijgt de
druk in het linker atrium, waardoor de klep van het foramen
ovale naar rechts, tegen het atriumseptum aan wordt gedrukt en
daarmee het foramen ovale grotendeels sluit (in 95% van de
gevallen is er gedurende enkele weken een links-rechtsshunt).
De ductus arteriosus gaat in constrictie door een toename van de
Atriumseptumdefecten worden onderverdeeld naargelang hun
lokalisatie (figuur 44.1). Het fossa-ovalis-defect, frequent
secundumdefect (ASD-II) genoemd, komt het meest voor. Het
open foramen ovale speelt in de foetale circulatie een cruciale
rol. Bij 95% van de pasgeboren is het atriumseptum incompetent met initieel een links-rechtsshunt die in de eerste levensmaanden meestal spontaan verdwijnt. Bij 30% van de volwassenen blijft het foramen ovale doorgankelijk. Een reële opening
ter hoogte van de fossa ovalis ontstaat wanneer de klep het
foramen ovale niet volledig bedekt doordat de klep te klein is,
volledig ontbreekt of geperforeerd is. Een aneurysma van het
atriumseptum gaat vaak gepaard met een open foramen ovale en
wordt bij obductie bij 10% van de populatie gevonden. Het
defect is niet altijd mooi centraal gelegen, maar kan verplaatst
zijn naar de inmonding van beide venae cavae. Het sinus-venosus-defect komt minder frequent voor en wordt gekenmerkt
door een verplaatsing van de inmonding van de vena cava superior (of, nog zeldzamer, van de vena cava inferior) waardoor
overrijding plaatsvindt over de intacte rand van de fossa ovalis.
Hierbij is vaak sprake van een bijkomende abnormale drainage
van de rechter longvenen. Associatie met een fossa-ovalis-
394
DEEL G CONGENITALE HARTAFWIJKINGEN, PERICARDZIEKTEN EN TUMOREN
factoren dan de toegenomen longdoorstroming hierbij een rol
zouden spelen. Het zou dan gaan om een toevallige associatie van
een atriumseptumdefect met primaire pulmonale hypertensie.
44.3.3 Klinische presentatie
Figuur 44.1 Lokalisatie van de verschillende soorten atriumseptumdefecten.
defect komt ook voor. Nog zeldzamer is het sinus-coronariusdefect, waarbij een partiële of totale verbinding ontstaat met het
linker atrium door de gemeenschappelijke wand heen.
Het atriumseptumdefect (ASD-II) is de meest voorkomende
aangeboren hartafwijking op volwassen leeftijd. Het wordt vaak
laat ontdekt omdat een ASD bij kinderen in veel gevallen geen
klachten of symptomen veroorzaakt. In de landelijke registratie
voor patiënten met een aangeboren hartafwijking (CONCOR) in
Nederland heeft 20% van alle geïncludeerde volwassen patiënten een ASD.
44.3.2 Pathofysiologie
Het defect in het atriumseptum geeft aanleiding tot een linksrechtsshunt. Een klein defect (verhouding tussen long- en
lichaamscirculatie < 1,5/1) zal geen belangrijke hemodynamische problemen veroorzaken. Echter, bij een toename van de
druk in het rechter atrium, zoals trouwens ook bij een open foramen ovale het geval kan zijn tijdens een valsalvamanoeuvre,
duiken, enzovoort of bij een pulmonalisstenose en pulmonalishypertensie, kan de shunt omkeren naar een rechts-linksshunt.
Zo kan er ook paradoxe embolisatie optreden. Bij een groter
defect is de richting van de shunt alleen nog afhankelijk van de
relatieve compliantie van beide ventrikels. Neonataal is deze
compliantie niet verschillend en de shunt is dus minimaal. Door
een afname van de longweerstand en het dunner worden van de
rechterventrikelwand neemt de vullingsdruk rechts af. Tegelijkertijd neemt de lichaamsvaatweerstand links toe en wordt de
spiermassa van het linker ventrikel groter, hetgeen resulteert in
een toename van de links-rechtsshunt. Er ontstaat volumebelasting rechts, met een toename van de longdoorstroming en de
longveneuze retour naar het linker atrium. De meeste patiënten
met een ASD zijn asymptomatisch op jonge leeftijd en presenteren zich pas met eventuele klachten na het dertigste levensjaar:
rechter hartfalen, veneuze congestie, evenals het optreden van
atriale aritmieën. Pulmonale weerstandshypertensie als gevolg
van secundaire veranderingen in de longarteriolen is zeldzaam,
zowel op de kinderleeftijd als bij oudere personen (slechts 10%
van de patiënten). Sommige auteurs suggereren zelfs dat andere
Een atriale shunt wordt op de kinderleeftijd meestal zeer goed
verdragen; zelden zijn er klachten zoals aanhoudende luchtweginfecties of ondermaatse gewichtstoename. Na twee tot drie
decennia treden er klachten op van moeheid, kortademigheid en
hartkloppingen. Zeer zelden zijn paradoxale embolieën of angina pectoris ten gevolge van ischemie van het rechter ventrikel de
eerste klinische symptomen.
Bij lichamelijk onderzoek is er een milde welving van de thorax
links, met een versterkte rechterventrikelimpuls. Bij auscultatie
is meestal een zacht ejectiegeruisje te horen op 2L door de relatieve pulmonalisstenose en een brede en gefixeerd gespleten
tweede toon (niet variërend met de ademhaling). Bij grote
shunts wijst een zacht middiastolisch geruisje op een relatieve
tricuspidalisstenose. Na het dertigste levensjaar worden toenemend atriale aritmieën gezien, waaronder vooral atriumfibrilleren, maar ook flutter en supraventriculaire tachycardieën. De Ptop is meestal normaal, maar met het toenemen van de leeftijd
wordt frequent dilatatie van het linker atrium gevonden. Een
rechter QRS-asdeviatie is frequent aanwezig maar niet obligaat.
De rechtsbelasting kan zich uiten in een karakteristiek rSr’- of
rsR-patroon in V1. De X-thorax toont een lichte tot matige cardiomegalie, een fors pulmonalissegment en een toegenomen
longvaattekening.
Met echocardiografie kunnen de plaats en de grootte van het
defect en de richting en de grootte van de shunt worden afgebeeld (figuur 44.2). Soms kan de druk in de arteria pulmonalis
worden berekend. Volumebelasting van het rechterhart resulteert
in een dilatatie van het rechter atrium en het rechter ventrikel en
soms in een paradoxale beweging van het ventrikelseptum. Het
sinus-venosus-defect kan makkelijk worden gemist. Bij inadequate beeldvorming moet transoesofageale echocardiografie
worden uitgevoerd.
Een diagnostische rechter hartkatheterisatie wordt alleen
gepland bij tekenen van ernstige pulmonale hypertensie waarbij
meting van de longvaatweerstand van belang is.
44.3.4 Therapie en lange termijnaspecten
In de eerste levensjaren kan een ASD-II zich spontaan verkleinen en zelfs sluiten. Een atriaal defect met een belangrijke linksrechtsshunt na de leeftijd van 3 jaar vormt een indicatie tot sluiting. Vele centraal gelegen fossa-ovalis-defecten kunnen tijdens
een hartkatheterisatieprocedure worden afgesloten met een
‘occluder-device’ (figuur 44.3). Is het defect echter te groot of is
de morfologie ervan ongunstig, dan wordt overgegaan tot chirurgische behandeling door primaire sluiting met hechtingen,
ofwel door het innaaien van een patch. Dit kan electief gebeuren op de leeftijd van 3-4 jaar. Een sinus-venosus- en een sinuscoronarius-defect kunnen alleen operatief worden gesloten met
44
CONGENITALE HARTZIEKTEN
395
Figuur 44.2 Echocardiografisch vierkamerbeeld van een atriumseptumdefect type II. Zichtbaar is een dilatatie van het rechter atrium en het rechter ventrikel.
Met kleurendoppleronderzoek is een links-rechtsshunt aantoonbaar. De rechter afbeelding toont het beeld na een kathetergebonden sluiting van het atriumseptumdefect.
LA = linker atrium; RA = rechter atrium.
behulp van een patch. Bij een belangrijke pulmonale weerstandshypertensie zijn de operatieve mortaliteit en morbiditeit
zeer hoog en bestaat er een contra-indicatie tot sluiting.
In 1976 is voor het eerst de niet-chirurgische transkathetersluiting van een ASD beschreven; inmiddels is deze techniek een
routineprocedure waarvoor verschillende ‘devices’ beschikbaar
zijn. Op dit moment zijn alleen een ASD-II en een persisterend
foramen ovale toegankelijk voor transkathetersluiting. De tech-
niek is veilig en meestal wordt volledige sluiting verkregen. Er
zijn echter wel enkele complicaties beschreven, zoals trombusvorming met eventueel embolisatie, ‘device’-embolisatie, ritmestoornissen en hartperforatie. Ook is in 0,1% van de gevallen
cardiale erosie beschreven, hetgeen kan leiden tot late ontwikkeling van pericardeffusie of zelfs harttamponnade. Tot een half
jaar na de procedure wordt momenteel het gebruik van acetylsalicylzuur en clopidogrel met antibiotische profylaxe geadviseerd.
Figuur 44.3 Kathetergebonden
sluiting van een atriumseptumdefect. Op het doorlichtingsbeeld is
de ontplooide occluder aan het
delivery-systeem te herkennen,
evenals de transoesofageale echokop. Het transoesofageale echobeeld is rechts afgebeeld.
LA = linker atrium; RA = rechter atrium.
396
Bij sluiting van een ASD vóór de leeftijd van 25 jaar is de prognose uitstekend, maar bij patiënten bij wie het ASD op oudere
leeftijd wordt gesloten, is de levensverwachting beduidend lager
dan bij een vergelijkbare normale populatie. De belangrijkste
voorspellende factoren voor een beperkte levensverwachting
zijn de leeftijd bij operatie en de pulmonalisdruk. Uit verschillende onderzoeken is gebleken dat sluiting van een ‘significant’
ASD (links-rechtsshunt > 1,5, rechterventrikeldilatatie en/of
verhoogde pulmonalisdrukken) bij patiënten ouder dan 25 jaar
vooral een gunstig effect heeft op de incidentie van cardiovasculaire complicaties en minder op de mortaliteit. In principe is
er een indicatie voor sluiting van een ASD bij alle patiënten met
tekenen van hemodynamische overbelasting van het rechter
ventrikel. Ook het optreden van een paradoxale embolie kan een
reden zijn om het ASD te sluiten. Bij vrouwen kan sluiting worden overwogen vóór een zwangerschap. Bij asymptomatische
patiënten ouder dan 25 jaar zonder tekenen van rechtszijdige
volume- of drukoverbelasting is het zeer twijfelachtig of sluiting
van het defect enig voordeel oplevert. Bij patiënten met bijkomende cardiale pathologie zoals coronairlijden, hypertensie of
mitralisinsufficiëntie zijn de operatiemorbiditeit en -mortaliteit
hoger (longoedeem!) en zijn de langetermijnvoordelen van operatie niet duidelijk aangetoond. Een irreversibel sterk verhoogde pulmonale vaatweerstand is een contra-indicatie voor sluiting
van een ASD. Sluiting kan dan leiden tot acuut rechterventrikelfalen en overlijden wanneer het rechter ventrikel de hoge druk
niet kan opbrengen. Voordat geconcludeerd wordt dat de verhoogde weerstand irreversibel is, dient altijd het effect van inhalatie van 100% zuurstof of stikstofmonoxide te worden nagegaan.
44.3.5 Persisterend foramen ovale, aneurysma
van het atriumseptum en cerebrovasculair
accident
Bij volwassen patiënten jonger dan 50 jaar met een cerebrovasculair accident (CVA) wordt bij 12-33% een cardiale afwijking
DEEL G CONGENITALE HARTAFWIJKINGEN, PERICARDZIEKTEN EN TUMOREN
gevonden die paradoxale embolieën kan faciliteren. Een persisterend foramen ovale (PFO) en een aneurysma van het atriumseptum worden tegenwoordig als zodanige afwijkingen
beschouwd. Bij ongeveer 30% van de normale populatie blijft
het foramen ovale open, met een diameter van 1-19 mm, gemiddeld 4-9 mm. Bij volwassenen met een onbegrepen CVA is de
prevalentie van een PFO duidelijk hoger (ongeveer 50%) dan in
een controlepopulatie (ongeveer 15%). Dit betekent dat een
PFO een risicofactor kan zijn voor een paradoxale embolie en
CVA. Met behulp van contrastechocardiografie kan een aanwezige rechts-linksshunt worden aangetoond, die ofwel spontaan
is ontstaan of geïnduceerd is door hoesten of een valsalvamanoeuvre (figuur 44.4). De normale links-rechtsdrukgradiënt
tussen de atria kan tijdelijk omgekeerd zijn, vroeg in de systole
of tijdens vele dagelijkse activiteiten die een valsalvamanoeuvre
induceren.
Een aneurysma van het atriumseptum wordt bij obductie bij
10% van de populatie gevonden; 0,2-4% bij transoesofageale
echocardiografie en 4-15% bij patiënten met een CVA. Een
aneurysma van het atriumseptum gaat vaak gepaard met een
PFO. Een combinatie van beide verhoogt het risico op een CVA.
De behandeling van patiënten met een CVA en een PFO of een
aneurysma van het atriumseptum is nog controversieel. Door de
onzekerheden over een causaal verband en ook door het gebrek
aan gegevens over het natuurlijke beloop en het risico op recidieven, worden deze patiënten empirisch behandeld. Aspirine,
orale anticoagulantia, filterimplantatie in de vena cava, percutane sluiting van een foramen ovale zijn opties die ook enige risico’s met zich brengen. Behandeling met aspirine lijkt een goede
optie voor patiënten met een PFO en een eerste CVA zonder
aantoonbare veneuze trombus. Kan er wel een veneuze trombus
worden aangetoond of is er spontane trombusvorming (proteïne
S, antitrombine-III, homocysteïne, lupus anticoagulans, factorV-Leiden), dan zijn (al of niet tijdelijk) orale anticoagulantia
geïndiceerd. Bij patiënten met een combinatie van een PFO en
een aneurysma van het atriumseptum en bij patiënten met reci-
Figuur 44.4 Transoesofageaal echobeeld van een kanaalvormig foramen ovale (pijl). Na toediening van echocontrast vult het rechter atrium (RA) zich en is er
contrastoverloop naar het linker atrium (LA).
44
397
CONGENITALE HARTZIEKTEN
diverende CVA’s kan percutane sluiting van het PFO geïndiceerd zijn. Percutane sluiting van een PFO lijkt momenteel een
effectieve en veilige procedure met dezelfde risico’s als percutane ASD-sluiting. Ondanks de rol van een PFO bij verschillende ziektebeelden blijft de indicatie voor het sluiten ervan controversieel. Zo bestaat er bij migrainepatiënten een verhoogde
incidentie van PFO, maar bij deze patiënten is er op dit moment
geen duidelijke concensus voor het sluiten ervan.
zijn vrij zeldzaam in een Kaukasische populatie, maar komen
frequent voor bij Aziaten. Als de septumcomponenten niet in
hetzelfde vlak liggen, spreekt men van een malalignment.
Deviatie van het uitstroomseptum kan leiden tot vernauwing van
het uitstroomtraject van een ventrikel: deviatie naar links resulteert in een subaortastenose, deviatie naar rechts in een subpulmonalisstenose (zoals bij een tetralogie van Fallot).
44.4.2 Pathofysiologie
44.4 Ventrikelseptumdefect
44.4.1 Morfologie
Ventrikelseptumdefecten (VSD) kunnen geïsoleerd voorkomen,
maar ook in combinatie met andere afwijkingen, zoals bij een
tetralogie van Fallot. Bij de onderstaande indeling wordt uitgegaan van geïsoleerd voorkomende defecten.
Het ventrikelseptum wordt verdeeld in drie musculeuze componenten: het instroomseptum tussen beide atrioventriculaire kleppen, het apicale trabeculaire septum en het subarterieel gelegen
uitstroom- of infundibulaire septum. Tussen deze septa in ligt
het fibreuze membraneuze septum. De indeling van de defecten
is op deze verdeling gebaseerd (figuur 44.5).
Het perimembraneuze ventrikelseptumdefect kan in grootte
sterk variëren en kan zich uitbreiden tot de musculeuze septumdelen, zowel naar het instroom- als het uitstroomseptum.
Het musculeuze ventrikelseptumdefect heeft een musculeuze
rand rondom en kan zich bevinden in zowel het instroomseptum, als het trabeculaire of uitstroomseptum. Het kan in grootte
sterk variëren en komt ook multipel voor (‘Swiss cheese’-VSD).
Bij subarterieel gelegen defecten is het uitstroomseptum afwezig, zodat de bovenrand van het VSD bestaat uit directe continuïteit tussen de aortaklep en de pulmonalisklep. Deze defecten
De hemodynamische gevolgen van een VSD worden bepaald
door de grootte van het defect en de longvaatweerstand. Kort na
de geboorte is de longvaatweerstand nog verhoogd en zal er
nauwelijks een shuntstroom optreden. In de daaropvolgende
uren-dagen-weken daalt de longvaatweerstand geleidelijk, hetgeen resulteert in een progressieve links-rechtsshunt door het
defect. Uiteindelijk kan de shuntgrootte zodanig toenemen dat
dit resulteert in hartfalen.
Bij een klein, zogenoemd restrictief defect beperkt de diameter
van het defect de grootte van de links-rechtsshunt.
Is het defect matig groot, dan wordt de shunt vaak tijdelijk goed
verdagen door de patiënt, al of niet met medicatie. Deze defecten kunnen zich spontaan verkleinen en zelfs sluiten.
Is het defect evenwel groter, dan wordt de mate van de linksrechtsshunt vooral bepaald door de weerstand in de longcirculatie. Bij een niet-restrictief defect persisteert een sterk verhoogde
druk in de longslagader met een zeer grote shunt. Klinisch vertaalt zich dit in decompensatio cordis, typisch op de leeftijd van
6-10 weken. Indien de patiënt deze fase overleeft, zullen zich in
de daaropvolgende jaren functionele en structurele veranderingen in het longvaatbed ontwikkelen: pulmonale plexogene arteriopathie. Deze vaatveranderingen veroorzaken een steeds verdere toename van de pulmonale vaatweerstand. Bij een VSD
kan dit uiteindelijk resulteren in een omkering van de bloedstroom in een rechts-linksshunt, hetgeen leidt tot systemische
arteriële hypoxemie (eisenmengersyndroom). Door tijdige chirurgische interventie, vaak al in de eerste levensmaanden, kan
dit dramatische beeld vrijwel altijd worden voorkomen.
Een VSD in de volwassen populatie kan zijn:
– een klein (rest)ventrikelseptumdefect met een kleine shunt
(< 1,5:1) en een normale rechterventrikeldruk;
– een ventrikelseptumdefect met een matig grote shunt en een
normale of licht verhoogde rechterventrikeldruk;
– een groot ventrikelseptumdefect met eisenmengersyndroom;
– een chirurgisch gesloten ventrikelseptumdefect zonder restshunt.
44.4.3 Klinische presentatie
Figuur 44.5 Verschillende typen ventrikelseptumdefect.
Het kenmerkende systolische geruis, gelokaliseerd laag langs de
linker sternale rand, wordt hoorbaar als er tussen het linker en
rechter ventrikel een drukverschil ontstaat. Bij pasgeborenen is
dit vaak na enkele uren of dagen. Is het defect groot, dan zal de
links-rechtsshunt geleidelijk toenemen, waarbij uiteindelijk een
atypisch laagfrequent geruis ontstaat. Een grote shunt leidt bij
398
de zuigeling tot versnelde vermoeibaarheid, zweten bij inspanning (drinken), tachypnoe en dyspnoe. De voedingsproblemen
en de te krappe calorische inname bij een verhoogde metabole
behoefte resulteren in dystrofie.
De voorachterwaartse diameter van de thorax kan toegenomen
zijn. Het holosystolische geruis is maximaal te horen op de
derde en vierde intercostale ruimte parasternaal links, soms
gecombineerd met een laagfrequent middiastolisch geruis over
de apex als gevolg van een relatieve mitralisstenose. Lokaal kan
een ‘thrill’ worden gevoeld. Bij zeer grote defecten is het geruis
zwak, zeker in aanwezigheid van pulmonale hypertensie, met
vaak een luide pulmonale component van de tweede harttoon.
Is het defect klein, dan zullen er geen verdere klachten of symptomen optreden. Kleine musculeuze defecten sluiten vaak spontaan in de eerste levensmaanden.
Bij grote defecten is op het ECG linkerventrikel- of biventriculaire hypertrofie zichtbaar. Bij pulmonale hypertensie kan ook
rechterventrikelhypertrofie optreden. Op de X-thorax is de hartcontour vergroot, met een toegenomen longvaattekening. Bij het
optreden van pulmonale weerstandshypertensie neemt na jaren
de perifere vaattekening af en is de stam van de arteria pulmonalis fors, met een opvallende vergroting van de centrale longarteriën.
Lokalisatie, grootte en hemodynamische gevolgen van een
VSD, zoals volumebelasting, zijn op het echocardiogram goed
te herkennen (figuur 44.6). Zeer kleine defecten zijn moeilijk te
visualiseren, maar kunnen met behulp van kleurendopplerechocardiografie vrijwel altijd worden opgespoord. Met behulp van
‘continuous wave’-doppler kan een schatting worden gemaakt
van het pieksystolische drukverschil tussen linker en rechter
ventrikel, en op die manier kan indirect de systolische druk in de
longslagader worden bepaald. Bij een oplopende longvaatweer-
DEEL G CONGENITALE HARTAFWIJKINGEN, PERICARDZIEKTEN EN TUMOREN
stand neemt de stroomsnelheid van het bloed over het defect af
en zal het rechter ventrikel in grootte toenemen en hypertrofiëren. Doorgaans zullen de niet-invasief verkregen gegevens voldoende zijn om de behandeling te sturen.
Hartkatheterisatie is alleen geïndiceerd bij een vermoeden van
pulmonale weerstandshypertensie na het eerste levensjaar.
44.4.4 Therapie
Bij kleine perimembraneuze defecten en soms zelfs bij grote
musculeuze defecten kan in de eerste levenjaren een spontane
verkleining en zelfs sluiting optreden. Daarnaast is voor kleine,
hemodynamisch onbelangrijke defecten geen behandeling geïndiceerd. Behoudens endocarditisprofylaxe zijn geen preventieve
maatregelen noodzakelijk en moeten zeker geen fysieke restricties worden opgelegd.
Als bij een zuigeling decompensatio cordis dreigt, worden diuretica voorgeschreven. Soms kan een ACE-remmer de shunt
controleerbaar maken. Vochtbeperking is niet aangewezen
omdat daarmee de opname van voedingsstoffen in het gedrang
komt. Calorisch verrijkte voeding moet vaak in frequente kleine
porties worden toegediend, zo nodig per maagsonde. Als dit niet
snel tot verbetering leidt, wordt het defect chirurgisch gesloten
met een patch. Bij ongunstig gelokaliseerde of multipele defecten kan als tussenstap initieel een bandje om de longslagader
worden aangelegd als palliatie, om aldus de shuntgrootte (en de
decompensatie) te beperken en de longvaten te behoeden voor
een te hoge druk. Later wordt dan in een tweede stap het bandje verwijderd en het defect gesloten.
Een kathetergebonden afsluiting van het VSD is mogelijk bij
sommige musculeuze en perimembraneuze defecten bij grotere
Figuur 44.6 Echocardiogram
van een ventrikelseptumdefect.
Met kleurendoppleronderzoek is
een links-rechtshunt aantoonbaar.
AAo = aorta ascendens; LA =
linker atrium; LV = linker ventrikel; RV = rechter ventrikel.
44
399
CONGENITALE HARTZIEKTEN
kinderen en volwassenen. De follow-up van deze techniek is
nog beperkt maar veelbelovend.
Bij kinderen met matig grote defecten zonder pulmonale hypertensie, die redelijk tot goed worden verdragen, wordt de eerste
maanden tot jaren een afwachtend beleid aangehouden. Deze
defecten kunnen spontaan kleiner worden. Blijft het defect aanleiding geven tot een hemodynamisch belangrijke links-rechtsshunt, of ontstaan een aortaklepprolaps en aortaklepinsufficiëntie, een subvalvulaire aortaklepstenose of een ‘double chambered
right ventricle’ (DCRV) met een significante obstructie in het
rechter ventrikel, dan zal alsnog tot sluiting worden overgegaan.
Als volledige sluiting is verkregen en er geen andere afwijkingen bestaan, vervalt de indicatie voor endocarditisprofylaxe
vanaf zes maanden na de ingreep. Is er sprake van ernstige, nietreversibele pulmonale hypertensie, dan is chirurgie gecontraindiceerd.
Bij de meeste volwassen patiënten met een VSD die een cardioloog bezoeken, is het defect in de kinderjaren gesloten. De
levensverwachting van deze patiënten is meestal zeer goed,
maar niet altijd normaal. Late postoperatieve complicaties zijn
progressieve pulmonale weerstandshypertensie, verminderde
linkerventrikelfunctie, aortaklepinsufficiëntie, ventriculaire aritmieën en een atrioventriculair blok. Het risico op endocarditis
blijft bestaan bij een rest-VSD of bij klepinsufficiënties.
samen bestaande uit vijf klepbladen: rechter anterosuperior
klepblad, rechter inferior klepblad, superior ‘bridging’ klepblad,
inferior ‘bridging’ klepblad en linker murale klepblad (figuur
44.7). Bij een compleet AVSD bestaat een septumdefect zowel
aan de atriale als aan de ventriculaire zijde van de gemeenschappelijke atrioventriculaire klepring. Bij een incompleet
AVSD zijn er twee aparte atrioventriculaire ostia en is er geen
VSD. Wel is er een – meestal groot – defect in het interatriale
septum. Het incomplete AVSD wordt ook wel ostium-primumdefect of ASD-I genoemd.
De pathofysiologie en klinische presentatie zijn afhankelijk van
de grootte van het VSD, het lek van de atrioventriculaire klep,
en in mindere mate van de ASD-component. Een compleet
AVSD presenteert zich zoals een groot VSD, verergerd met de
bijkomende insufficiëntie van de rechter en linker atrioventriculaire klep. Door de massale links-rechtsshunt in combinatie met
de linker atrioventriculaire klepinsufficiëntie zal de pulmonale
‘flow’-hypertensie snel overgaan in een ‘weerstands’hypertensie. Indien de zuigeling dit overleeft, treedt na een decennium
bidirectionele shunting op met voornamelijk een rechts-linksshunt en cyanose. Bij een incompleet AVSD zijn de hemodynamische verhoudingen vergelijkbaar met die van een ASD-II.
Door forse linkszijdige atrioventriculaire klepinsufficiëntie kan
de atriale links-rechtsshunt echter toenemen.
44.5 Atrioventriculair septumdefect
44.5.2 Klinische presentatie
44.5.1 Inleiding
Het atrioventriculaire septumdefect (AVSD) bestaat uit een
spectrum van laesies met één grote gemeenschappelijke atrioventriculaire junctie en abnormale atrioventriculaire kleppen,
Het complete atrioventriculaire septumdefect komt incidenteel
voor bij kinderen zonder chromosomale afwijking, maar frequent bij kinderen met het syndroom van Down. Bij een patiënt
met een compleet atrioventriculair septumdefect met een substantiële ventriculaire component treedt enkele weken na de
Figuur 44.7 a Schematische
weergave van een normaal hart
met normale mitralisklep (M)
en tricuspidalisklep (T). b Een
compleet atrioventriculair septumdefect (AVSD) met in
plaats van een mitralis- en een
tricuspidalisklep een gezamenlijke klep met een rechter anterosuperior klepblad (1), een
rechter inferior klepblad (2),
een superior bridging klepblad
(3), een inferior bridging klepblad en een linker muraal klepblad (5). c De situatie bij een
incompleet AVSD.
a = aorta; p = pulmonalis.
a
b
c
DEEL G CONGENITALE HARTAFWIJKINGEN, PERICARDZIEKTEN EN TUMOREN
400
geboorte decompensatie op (zie paragraaf 44.4.3). Indien toch
vroegtijdige decompensatie in de eerste levensdagen optreedt, is
dit een gevolg van geassocieerde massale atrioventriculaire klepinsufficiëntie.
Een incompleet atrioventriculair septumdefect gedraagt zich,
indien er geen ernstige klepinsufficiëntie is, als elke andere
shunt op atriumniveau, zonder – of slechts met zeer milde – klinische symptomen.
De fysische diagnostiek van het atrioventriculaire septumdefect
heeft enkele specifieke kenmerken. De auscultatie van het
incomplete AVSD wordt gekenmerkt door de gefixeerde splijting van de tweede harttoon, vaak samen met een hoogfrequent,
holosystolisch (mitralisinsufficiëntie)geruis op de apex. Bij auscultatie van het complete AVSD staat vaak het hoogfrequente,
holosystolische, bandvormige geruis van de insufficiëntie van de
atrioventriculaire klep op de voorgrond, maar soms is afzonderlijk een ruw ventrikelseptumdefectgeruis te horen op de vierde
intercostale ruimte parasternaal.
Het ECG toont soms een eerstegraads AV-blok. Door de posterieure ligging van de AV-knoop verloopt de ventrikeldepolarisatie
anders dan normaal. Bij een incompleet atrioventriculair defect
resulteert dit vaak in een naar links gedevieerde as tussen de
–30 en –90°. Bij het complete atrioventriculaire defect is de
frontale elektrische hartas vrijwel altijd nog verder naar links
gedevieerd, tussen –90 en –150°. Bij het incomplete AVSD zullen tekenen van volumebelasting van het rechter ventrikel op de
voorgrond staan (rSR’ in V1). Bij het complete AVSD wordt
meestal biventriculaire hypertrofie gezien
Op de X-thorax is het hart vergroot, met een toegenomen longvaattekening.
Echocardiografisch onderzoek is altijd diagnostisch. Het vinden
van een gelijke insertie van de beide AV-kleppen is pathogno-
monisch. Bij grote defecten aan de atriale en de ventriculaire
zijde is de echodiagnose eenvoudig. Bij kleinere defecten is de
differentiatie tussen compleet of partieel AVSD soms moeilijk.
Driedimensionale echografie is veelbelovend voor de juiste anatomische beschrijving van de AV-klep.
Een diagnostische hartkatheterisatie is zelden geïndiceerd.
Soms wordt katheterisatie uitgevoerd bij een oudere patiënt voor
de beoordeling van de pulmonale vaatweerstand en voor de
meting van de vasoreactiviteit van het pulmonale vaatbed.
44.5.3 Therapie en prognose
De levensverwachting van patiënten met een compleet AVSD is
zonder operatief ingrijpen zeer beperkt en veel patiënten overleven de fase van zuigelingendecompensatie niet. Overleeft de
patiënt deze fase, dan evolueert het defect naar het eisenmengersyndroom. Daarom is chirurgische correctie op jonge leeftijd
aangewezen, meestal vóór de leeftijd van 4 à 5 maanden (figuur
44.8). Patiënten met een geopereerd compleet AVSD moeten
levenslang worden gecontroleerd in verband met frequente restafwijkingen na operatie: rest-VSD, (progressieve) insufficiëntie
van de linker AV-klep, pulmonale hypertensie en ook vaak
ritme- of geleidingsstoornissen. Bij patiënten met het syndroom
van Down en een compleet AVSD bestaat er een hoger risico op
progressieve pulmonale hypertensie, ook na operatieve correctie.
Belangrijk is het blijvend anatomisch afwijkende AV-klepapparaat na reconstructie. De abnormale anatomie van het AV-klepapparaat kan bij echocardiografisch onderzoek gemakkelijk leiden tot een verkeerde interpretatie en worden verward met bijFiguur 44.8 a Systolisch vierkamerbeeld van een compleet
AVSD, waarbij er zowel op atriaal als op ventriculair niveau
een communicatie bestaat.
b Beeld na operatie waarbij
door de chirurg patches zijn
geplaatst in de ventriculaire en
atriale component van het
defect.
LA = linker atrium; LV = linker ventrikel; RA = rechter atrium; RV =
rechter ventrikel.
a
b
44
401
CONGENITALE HARTZIEKTEN
voorbeeld vegetaties bij endocarditis. Ook functioneel kan de
gereconstrueerde linker AV-klep toenemend insufficiënt worden. Een goede follow-up is noodzakelijk om het juiste tijdstip
van een tweede reconstructie of klepvervanging te bepalen.
Door de bijkomende afwijkingen van de linker AV-klep en het
geleidingssysteem is het natuurlijke beloop van een incompleet
AVSD aanmerkelijk gunstiger dan dat van een compleet AVSD,
maar in het algemeen slechter dan het natuurlijke beloop van
een ander type ASD. Door insufficiëntie van de linker AV-klep
zal de links-rechtsshunt toenemen en eerder dan bij een ASD-II
leiden tot pulmonale hypertensie. Meestal bestaat er door de
grote links-rechtsshunt al op de kinderleeftijd een indicatie voor
sluiting van het defect. De anatomisch abnormale linker AV-klep
kan meestal enigszins worden gereconstrueerd, maar een lichte
insufficiëntie moet bijna altijd worden geaccepteerd. Bij deze
patiënten blijft endocarditisprofylaxe altijd geïndiceerd. Een
enkele keer zal een progressieve insufficiëntie in een later stadium een tweede valvuloplastiek dan wel klepvervanging noodzakelijk maken. Bij de meeste patiënten blijft de insufficiëntie van
de linker AV-klep echter mild. Toch is regelmatige evaluatie
geïndiceerd. Late morbiditeit bij een geopereerd incompleet
AVSD is niet alleen gerelateerd aan de insufficiëntie van de linker AV-klep. Er treden ook frequent ritme- en geleidingsstoornissen op zoals atriumfibrilleren, paroxismale supraventriculaire tachycardieën, compleet hartblok of sinusknoopdisfunctie.
Het aantal cardiale complicaties tijdens een zwangerschap bij
vrouwen met een (gerepareerd) AVSD is aanzienlijk hoger dan
bij patiënten met een ASD-II. Complicaties zijn vooral ritmestoornissen, verergering van de insufficiëntie van de linker AVklep en blijvende verslechtering van de NYHA-klasse. Manifeste decompensatio cordis komt zelden voor. Bij een ernstige
insufficiëntie kan worden overwogen een plastiek van de linker
AV-klep te verrichten of een bioprothese te implanteren vóór
een eventuele zwangerschap. Bij een matig verhoogde pulmonale vaatweerstand is het risico van een zwangerschap aanzienlijk groter. Bij een gefixeerde verhoogde pulmonale vaatweerstand ontbreekt een snelle aanpassing aan schommelingen in de
systeemvaatweerstand, cardiac output en bloedvolume tijdens
de partus en in het kraambed. Bij ernstige pulmonale vaatweerstandsverhoging (eisenmengersyndroom) is het risico zo hoog
dat zwangerschap gecontra-indiceerd is.
Het herhalingsrisico voor het kind is relatief hoog, vooral wanneer de moeder een AVSD heeft. In het licht van het risico op
monogene afwijkingen is erfelijkheidsadvies door een klinisch
geneticus altijd geïndiceerd.
44.6 Persisterende ductus arteriosus (Botalli)
44.6.1 Morfologie
In de foetale circulatie vormt de ductus arteriosus (Botalli) een
levensnoodzakelijke verbinding tussen de stam van de arteria
pulmonalis en de aorta descendens. Prenataal is de diameter van
de ductus vrijwel gelijk aan die van de aorta descendens. Na de
geboorte sluit de ductus functioneel in de eerste levensdagen;
morfologisch is de ductus binnen twee weken gesloten. Sluiting
vindt plaats door constrictie en verkleving van de intima. Dit proces verloopt bij prematuur geboren kinderen vaak vertraagd. Een
abnormale bouw van de wand van de ductus is verantwoordelijk
voor het openblijven op lange termijn. Een persisterende ductus
kan voorkomen als geïsoleerde afwijking, maar ook in combinatie met zowel cyanotische als niet-cyanotische hartafwijkingen.
44.6.2 Pathofysiologie
Vóór de geboorte vormt de ductus een uitweg naar de lichaamscirculatie van het door het rechter ventrikel gepompte bloed. De
relatieve hypoxie (foetale saturatie rond 65%) met een hoog
gehalte aan circulerende prostaglandinen houdt de ductus prenataal open.
Blijft de ductus na de geboorte open, dan zal er een links-rechtsshunt ontstaan die leidt tot een volumebelasting van de linker
harthelft. De shuntgrootte is afhankelijk van de diameter van de
ductus en van de longvaatweerstand. De consequenties hiervan
zijn vergelijkbaar met die zoals beschreven bij het VSD en kunnen variëren van een restrictieve ductus met een hemodynamisch
onbelangrijke links-rechtsshunt tot een grote links-rechtsshunt
met secundaire pulmonale hypertensie, eventueel op termijn
gevolgd door pulmonale weerstandshypertensie.
44.6.3 Klinische presentatie
Bij de prematuur geborene kan de vertraagd sluitende ductus
door de vergrote longcirculatie bijdragen aan respiratoire insufficiëntie. Bij de zuigeling en het oudere kind kunnen dyspnoe
bij inspanning en versnelde vermoeibaarheid optreden. Bij de
zuigeling kan dit leiden tot voedingsproblemen en onvoldoende
gewichtstoename. Een kleine ductus geeft geen aanleiding tot
klachten.
Bij lichamelijk onderzoek zijn door de vergrote polsdruk de
perifere pulsaties soms opvallend goed te voelen. Bij een grote
shunt is er dyspnoe en tachypnoe, vooral tijdens inspanning.
Karakteristiek is het continue (systolisch-diastolische) geruis
subclaviculair links. Bijkomende pulmonale hypertensie leidt
tot een versterkte tweede harttoon en het eventueel korter worden van het geruis.
Het ECG toont bij een belangrijke shunt linkerventrikel- of
biventriculaire hypertrofie. Op de X-thorax is de hartcontour
dan verbreed en de longvaattekening toegenomen. Op het ECG
is de volumebelasting te herkennen als een vergroting van het
linker atrium en ventrikel. Met kleurendoppleronderzoek kan de
shunt ter hoogte van de uitmonding in de arteria pulmonalis
worden aangetoond.
Hartkatheterisatie zal worden verricht als nadere informatie
over de shuntgrootte en de vaatweerstand van belang is, maar
wordt meestal uitgevoerd om tegelijkertijd de ductus te sluiten.
DEEL G CONGENITALE HARTAFWIJKINGEN, PERICARDZIEKTEN EN TUMOREN
402
44.6.4 Therapie en langetermijnaspecten
Bij de prematuur geborene bij wie de nog niet spontaan gesloten ductus klinische problemen veroorzaakt, kan met behulp van
prostaglandineantagonisten zoals ibuprofen (of vroeger indometacine) het sluitingsproces worden versterkt. Soms is dit niet
effectief en is chirurgische sluiting aangewezen.
Bij à terme geboren kinderen kan de ductus zich in de eerste drie
levensmaanden soms vertraagd spontaan sluiten. Bij een belangrijke volumebelasting moet de ductus in de eerste levensmaanden chirurgisch worden gesloten. Als alternatief voor chirurgische sluiting kan vanaf de leeftijd van een half jaar de ductus
worden gesloten met behulp van een soort plug of trombogene
spiraaltjes (figuur 44.9). Bij een zeer grote ductus verdient chirurgische sluiting soms de voorkeur boven een katheterinterventie. Net als bij een groot VSD moet een grote, weinig restrictieve ductus tijdig worden behandeld om irreversibele pulmonale
weerstandshypertensie te voorkomen. Vooral met het oog op het
cumulatieve risico op endarteriitis (1,0-1,5% per jaar) dat niet
aan de hand van shuntgrootte of ductusdiameter te voorspellen
is, worden ook kleine shunts in principe gesloten.
Vanaf drie maanden na volledige sluiting van de ductus is er
geen indicatie meer voor endocarditisprofylaxe. De langetermijnprognose na behandeling is goed.
Door de ontwikkeling van dopplerechotechnieken is er een nieuwe groep patiënten ontdekt met een zogenaamde ‘stille’ ductus:
een minishunt bij dopplerecho-onderzoek zonder hoorbaar
geruis. Op grond van de huidige literatuur is sluiting van een stille ductus zonder klinische verschijnselen niet geïndiceerd.
44.7 Eisenmengersyndroom
44.7.1 Inleiding
Als de toegenomen bloedstroom door de longen via een ASD,
VSD of persisterende ductus arteriosus (Botalli) leidt tot een
sterk verhoogde pulmonale vaatweerstand, zal de links-rechts-
Figuur 44.10 MRI-opname van een patiënt met het eisenmengersyndroom
ten gevolge van een VSD (pijl). Er is sprake van rechterventrikelhypertrofie
en een duidelijke dilatatie van de arteria pulmonalis. RV = rechterventrikel;
LV = linkerventrikel; AP = arteria pulmonalis.
shunt via het defect afnemen en zal uiteindelijk een rechts-linksshunt ontstaam. Er is dan sprake van het eisenmengersyndroom.
Dit syndroom komt voor bij ongeveer 50% van de patiënten met
een groot VSD of een persisterende ductus arteriosus (Botalli)
en wel op de kinderleeftijd; van de patiënten met een groot ASD
slechts bij 10%, en dan pas op volwassen leeftijd (figuur 44.10).
Behalve bij de genoemde defecten kan het eisenmengersyndroom natuurlijk ook ontstaan bij een andere shunt tussen systeem- en longcirculatie. De chronisch verhoogde druk in het
longvaatbed veroorzaakt progressieve histologische veranderingen in de longvaten die uiteindelijk onomkeerbaar worden. Sluiten kan leiden tot acuut rechterventrikelfalen en een laag hartdebiet; cyanose wordt beter verdragen dan een laag hartdebiet.
Een irreversibel sterk verhoogde pulmonale vaatweerstand is
daarom een contra-indicatie voor operatieve sluiting van een
Figuur 44.9 a Lateraal angiogram van de aortaboog met via
een open ductus vulling van de
arteria pulmonalis. b Na kathetergebonden occlusie van de
ductus met een vaatplug (pijl)
is de links-rechtsshunt opgeheven. AP = arteria pulmonalis;
Ao = aorta.
a
b
44
CONGENITALE HARTZIEKTEN
defect als ASD, VSD of persisterende ductus arteriosus (Botalli). Voordat geconcludeerd wordt dat de verhoogde weerstand
irreversibel is, moet altijd het effect van pulmonale vasodilatatie
(inhalatie van 100% zuurstof, stikstofoxide of prostacycline)
worden nagegaan.
44.7.2 Klinische verschijnselen
De klinische verschijnselen zijn onafhankelijk van de plaats van
de shunt. De klachten zijn vooral het gevolg van hyperviscositeit door polycytemie en hypoxemie. Dyspnée d’effort, hemoptoë, angina pectoris en supraventriculaire tachycardieën, atriumfibrilleren en klachten ten gevolge van rechterventrikelfalen
kunnen optreden. Bij patiënten met het eisenmengersyndroom
en centrale cyanose is het oorspronkelijke shuntgeruis niet of
nog nauwelijks hoorbaar. De pulmonale component van de
tweede toon is luid (vaak palpabel), een vierde toon en een pulmonale ejectietoon kunnen hoorbaar zijn en er is een rechterventrikelimpuls. De geruisen ontstaan niet meer door het oorspronkelijke defect, maar door de pulmonale hypertensie: een
vroegdiastolisch geruis ten gevolge van pulmonalisinsufficiëntie
en een holosystolische souffle ten gevolge van tricuspidalisinsufficiëntie.
De overleving van patiënten met het eisenmengersyndroom is
ongeveer 75% bij 30 jaar en 55% bij 50 jaar. Er zijn patiënten
beschreven die een aanzienlijk hogere leeftijd, tot 65 jaar,
bereikten. Het is opvallend dat patiënten met secundaire pulmonale hypertensie veel langer in leven blijven dan patiënten met
primaire pulmonale hypertensie. De belangrijkste doodsoorzaken zijn plotse dood door een ritmestoornis (14-47%), rechterventrikelfalen, bloeding of trombose (waaronder hemoptoë),
infectie (cerebraal abces, zelden endocarditis), niet-cardiale
operaties onder algehele anesthesie en zwangerschap.
44.7.3 Specifieke maatregelen
Er is geen gestandaardiseerde behandeling voor patiënten met
het eisenmengersyndroom. Het belangrijkste bij de behandeling
is het vermijden van factoren die het wankele hemodynamische
evenwicht kunnen verstoren. Dehydratie, verblijf op grote hoogte en isometrische inspanning moeten worden vermeden. Erytrocytose, secundair aan een verhoogd erytropoëtinegehalte als
reactie op de chronische hypoxemie, kan door hyperviscositeit
van het bloed de volgende klachten veroorzaken: hoofdpijn, duizeligheid, visusstoornissen, moeheid, spierpijn of spierzwakte
en paresthesieën.
Flebotomie wordt alleen geadviseerd bij patiënten die zowel
duidelijke klachten van hyperviscositeit als een hematocriet
> 65% hebben. Flebotomie moet altijd gecombineerd worden
met toediening van eenzelfde volume vloeistof als de hoeveelheid bloed die werd afgenomen. Anders kan afname van het circulerende volume leiden tot een catastrofale hemodynamische
collaps. Flebotomie wordt niet geadviseerd bij patiënten met
een hoge hematocriet zonder klachten. Herhaalde flebotomieën
kunnen namelijk leiden tot een ijzergebrekanemie. De microcy-
403
taire hypochrome erytrocyten bij een ijzergebrekanemie hebben
een verminderde capaciteit om zuurstof te transporteren en zijn
meer rigide, waardoor de hyperviscositeit toeneemt. Als frequente flebotomieën toch noodzakelijk zijn, kan in aansluiting
aan de transfusie intraveneus 5 ml van het ijzerpreparaat ferrioxidesacharaat worden toegediend ter voorkoming van ijzergebrekanemie.
Zuurstoftoediening is geïndiceerd bij patiënten die herstellen
van een operatie, tijdens een ziekenhuisopname in verband met
ernstig hartfalen, bij een verblijf op grote hoogten en rond een
bevalling. Chronische toediening van zuurstof thuis kan subjectief vaak een verlichting van de klachten (bijvoorbeeld hoofdpijn) geven, maar objectief is nooit een gunstig effect op inspanningstolerantie of op de prognose aangetoond.
Anticoagulantia of aspirine worden soms voorgeschreven ter
vermindering van trombotische complicaties. Echter, bij patiënten met het eisenmengersyndroom is het risico op bloedingen
(hemoptoë!) al verhoogd door een trombocytopathie en een
tekort aan stollingsfactoren. Een netto gunstig effect van anticoagulantia is bij dit syndroom nooit aangetoond.
Door een verhoogd metabolisme van urinezuur kan jicht ontstaan bij patiënten met het eisenmengersyndroom. Daarnaast
kunnen gewrichtsklachten ook veroorzaakt worden door
periostprikkeling die het gevolg is van het sterk gezwollen
hyperactieve beenmerg (hypertrofische osteoartropathie).
Een cerebraal abces kan zich ontwikkelen door embolisatie via
de rechts-linksshunt van een infectieus proces elders in het
lichaam. Bij klachten van hoofdpijn, misselijkheid en sufheid of
bij persoonlijkheidsstoornissen moet men bedacht zijn op deze
zeldzame, maar vaak dodelijk verlopende complicatie.
Glomerulusssclerose, ten gevolge van cyanose, komt meestal in
eerste instantie tot uiting als proteïnurie.
Ten slotte bestaat er bij patiënten met erytrocytose een verhoogd
risico op galstenen en cholecystitis door de vorming van calciumbilirubinegalstenen.
Tegenwoordig worden nieuwe vormen van medicamenteuze therapie – prostacycline of epoprostenol, bosentan en sildenafil –
geprobeerd bij patiënten met het eisenmengersyndroom, met het
doel de longvaatweerstand te verlagen en de cardiac output en
functionele klasse te verbeteren. Longtransplantatie met sluiting
van het intracardiale defect of een gecombineerde hart-longtransplantatie kan worden overwogen als de 1-jaarsoverleving op
minder dan 50% wordt geschat. Een zorgvuldige selectie is
noodzakelijk, omdat de gemiddelde 1-jaarsoverleving na een
hart-longtransplantatie 70% bedraagt en na alleen een longtransplantatie slechts 50%.
Bij patiënten met het eisenmengersyndroom vormt zwangerschap een zeer hoog risico. Bij een gefixeerde pulmonale
vaatweerstand ontbreekt een snelle aanpassing aan schommelingen in de systeemvaatweerstand, cardiac output en bloedvolume
tijdens de partus en in het kraambed. Bij patiënten met dit syndroom is het risico op dood van de moeder tijdens of vlak na de
zwangerschap 30-70%.
404
44.8 Coarctatio aortae
44.8.1 Morfologie
Bij een coarctatio aortae bestaat er een circumscripte insnoering
in de aorta, aan de overgang van aortaboog naar aorta descendens, net voor – of ter hoogte van – de inmonding van de ductus arteriosus. Proximaal van de coarctatie heeft de aortaboog
vaak een kleiner kaliber dan normaal, distaal ervan is de aorta
descendens verwijd. De linker arteria subclavia kan proximaal
of distaal van de coarctatie ontspringen. Collaterale vaten kunnen zich ontwikkelen tussen het voor en na de coarctatie gelegen deel van de aorta.
In ongeveer 50% van de gevallen komt de coarctatie geïsoleerd
voor. In de overige 50% is er sprake van bijkomende intracardiale pathologie; dit wordt aangeduid als ‘complexe coarctatie’.
Het meest voorkomend zijn een bicuspide aortaklep (40-85%),
ventrikelseptumdefect (28-35%), aortaklepstenose (10-13%),
subaortale stenose (10-25%), transpositie van de grote vaten
(8-16%) en complexe hartafwijkingen (10-15%).
44.8.2 Pathofysiologie
Voor de geboorte en bij de pasgeborene verzorgt de ductus arteriosus de bloedtoevoer naar de onderste lichaamshelft. Indien er
foetaal een verminderde flow is door het linker hart (bijvoorbeeld
bij een restrictief foramen ovale, mitralisklepstenose, kleine mitralisklep bij een persisterende linker vena cava superior, ventrikelseptumdefect met malalignment, subvalvulaire aortastenose,
aortaklepstenose) kan de flow door de distale aortaboog en
isthmus zo laag worden, dat deze hypoplastisch blijft en een
coarctatie vertoont. Foetaal en de eerste uren neonataal is er een
adequate flow naar de onderste lichaamshelft door de ductus. Als
de ductus sluit, door contractie van de musculeuze component
van de arterie, dient alle flow door de nauwe isthmuscoarctatie te
vloeien. Soms ontstaat een coarctatie in een voorheen ‘goede’
aortaboog door uitlopers van ductusweefsel in de aorta.
Is de doorgankelijkheid van de aortaboog zeer beperkt (door
hypoplasie van de distale boog met nauwe coarctatie), dan resulteert dit bij de neonatus in cardiogene shock, typisch op dag
3-7, met soms een late presentatie tot dag 30.
Is de doorgankelijkheid van de aortaboog ‘behoorlijk’, dan ontwikkelt de patiënt belangrijke collaterale vaten, waardoor het
hemodynamisch belang (tijdelijk) afneemt. In de bovenste
lichaamshelft persisteert dan wel belangrijke arteriële hypertensie.
DEEL G CONGENITALE HARTAFWIJKINGEN, PERICARDZIEKTEN EN TUMOREN
tachycardie en respiratoire insufficiëntie. Het kind is zeer bleek,
met een slechte perifere circulatie en niet of nauwelijks voelbare pulsaties aan armen én benen. De lever is sterk vergroot. Auscultatie is niet specifiek. Verminderde pulsaties aan de arteria
femoralis zijn suggestief voor de afwijking. De X-thorax toont
een sterk vergroot hart met overvulling van de longvaten. Op het
ECG is opvallend veel rechterventrikelactiviteit te zien, met een
sterk naar rechts staande hartas.
De coarctatie kan meestal zichtbaar worden gemaakt op het
echocardiogram, evenals bijkomende hypoplasie van de aortaboog, de mate van sluiting van de ductus en eventuele intracardiale afwijkingen. Katheterisatie en angiocardiografie zijn zelden nodig ter completering van de diagnose.
Bij oudere kinderen en bij volwassenen wordt het klinische
beeld bepaald door een geïsoleerde coarctatie. De patiënten zijn
veelal asymptomatisch, soms zijn er klachten ten gevolge van
hypertensie aan de bovenste lichaamshelft (hoofdpijn, duizeligheid of herhaalde neusbloedingen) of door een verminderde
doorbloeding van de onderste lichaamshelft (vermoeidheid, tintelend gevoel of claudicatie in de benen bij inspanning en koude
voeten). De liespulsaties zijn veel zwakker dan die aan de
bovenste lichaamshelft. Bij een distaal van de coarctatie ontspringende linker arterie subclavia zijn ook de pulsaties aan de
linker arm verminderd. Bloeddrukmeting aan beide armen en
aan één been zal het drukverschil bevestigen. Bij een langdurig
bestaande collaterale circulatie zijn pulserende intercostale arteriën subscapulair op de rug palpabel. Bij auscultatie wordt na de
eerste toon nogal eens een ejectieklik gehoord ten gevolge van
een bicuspide aortaklep. Het systolische geruis is vaak het best
te horen links paravertebraal op de rug, maar kan niet altijd worden onderscheiden van dat van collateralen en een ejectiegeruis
over het aortaostium. Het ECG is normaal of toont aanwijzingen
voor linkerventrikelhypertrofie.
Op de X-thorax is de hartgrootte normaal. De aorta ascendens
kan iets verbreed zijn. Soms is vlak boven de pulmonalisknop
een duidelijke insnoering van de aorta ter hoogte van de coarctatie aanwezig. Ribusuren ten gevolge van de wijde intercostale
arteriën zijn zelden zichtbaar bij kinderen jonger dan 6 jaar.
Echocardiografie toont de mate van linkerventrikelhypertrofie
en vaak ook de coarctatie. Dopplerechocardiografie steunt de
diagnose door de systolische stroomversnelling over het vernauwde traject, het karakteristieke diastolische flowpatroon in
de distale aortaboog en de sterk gedempte ‘zaagtandcurve’ in de
aorta abdominalis. Bij volwassenen is het vaak aangewezen de
coarctatie af te beelden met behulp van CT, MRI of angiografie
wegens een beperkte echogeniciteit (figuur 44.11).
Een coarctatio aortae zonder bijkomende intracardiale afwijkingen komt voor bij 10% van alle patiënten met het syndroom van
Turner (XO).
44.8.3 Klinische presentatie
44.8.4 Therapie en langetermijnaspecten
Er is een opvallend verschil tussen de presentatie bij de jonge
zuigeling en die bij oudere kinderen en volwassenen.
Bij de jonge zuigeling, met een complexe coarctatie, ontstaat bij
het sluiten van de ductus een zeer acuut beeld. Er ontwikkelt
zich in zeer korte tijd ernstig hartfalen: cardiogene shock met
Bij een pasgeborene met ernstig hartfalen kan de klinische toestand vaak sterk worden verbeterd door de ductus arteriosus met
behulp van prostaglandinen te heropenen. Hartfalen moet worden behandeld met correctie van acidose, inotrope ondersteu-
44
405
CONGENITALE HARTZIEKTEN
stenose met een end-to-end-anastomose (figuur 44.12). Vroeger
werd ook wel een patch-angioplastiek verricht, maar deze techniek wordt niet meer toegepast in verband met het grote risico
op aneurysmavorming. Ook de ‘subclavian flap’-operatie wordt
na de zuigelingenleeftijd niet meer uitgevoerd. Is resectie met
een end-to-end-anastomose niet mogelijk, bijvoorbeeld bij een
langgerekte stenose, dan zijn er alternatieven zoals interpositie
van een graft, de zogenoemde ‘extended arch repair’ of het
plaatsen van een bypass. De mortaliteit van de operatie is laag,
maar neemt toe met de leeftijd. Een zeldzame maar ernstige
complicatie is een dwarslaesie. Na de operatie kan ernstige
reboundhypertensie ontstaan.
Figuur 44.11 MR-angiogram van een recoarctatio (reCoA).
ning en (vaak) kunstmatige ventilatie. Nadat hiermee de klinische situatie is gestabiliseerd, kan de vernauwing chirurgisch
worden opgeheven. Bijkomende intracardiale afwijkingen worden vaak al in dezelfde procedure gecorrigeerd. De meest
gebruikte chirurgische techniek is een resectie van de coarctatie
met een brede end-to-end-anastomose.
Na de zuigelingenleeftijd zal de operatie voor een geïsoleerde
coarctatie vaak electief kunnen plaatsvinden. Indicatie voor
interventie is hypertensie aan de bovenste lichaamshelft en een
systolisch drukverval van meer dan 20 mmHg over de coarctatie. De chirurgische techniek van voorkeur is resectie van de
De afgelopen jaren is ballondilatatie als alternatief voor chirurgie naar voren gekomen. De resultaten wat betreft gradiëntreductie lijken vergelijkbaar met die van chirurgie, maar op de
dilatatieplaats komt iets vaker aneurysmavorming voor. Bij het
uitgegroeide individu kan deze complicatie mogelijk worden
voorkomen door gelijktijdige plaatsing van een stent. Bij een
recoarctatie is ballondilatatie, al of niet met stentimplantatie,
inmiddels als eerstekeustherapie geaccepteerd.
Ook in België en Nederland komt het nog voor dat de diagnose
coarctatio aortae pas op volwassen leeftijd wordt gesteld. Een
populatie kan heel gemakkelijk worden gescreend door het voelen naar adequate liespulsaties. Bij analyse van (onbegrepen)
hypertensie is het dan ook noodzakelijk dat de bloeddruk wordt
gemeten aan armen en benen.
44.8.5 Follow-up
Patiënten die behandeld zijn wegens een coarctatio aortae moeten levenslang worden gecontroleerd, omdat er belangrijke restmorbiditeit en -mortaliteit zijn, die zich ook op latere leeftijd
Figuur 44.12 Schematische weergave van een coarctatio aortae (CoA). De coarctatie wordt gecorrigeerd door resectie van het vernauwde gedeelte met een
primaire ‘extended’ end-to-end-anastomose.
AB = aortaboog; AD = aorta descendens.
406
DEEL G CONGENITALE HARTAFWIJKINGEN, PERICARDZIEKTEN EN TUMOREN
kunnen manifesteren. Factoren die de prognose negatief kunnen
beïnvloeden en die aandacht vereisen bij de follow-up van
patiënten met coarctatie zijn:
– restcoarctatie of recoarctatie;
– hypertensie in rust en/of tijdens inspanning zonder recoarctatie;
– prematuur coronairlijden;
– aneurysma van de aorta ascendens bij een asymmetrische
(bicuspide) aortaklep;
– dissectie van de aorta;
– intracraniale bloeding;
– linkerarm: verminderde groei/claudicatie;
– endocarditis/endarteriitis;
– bijkomende intracardiale afwijkingen (vooral van de aortaklep).
44.9 Pulmonalisklepstenose
Een recoarctatie ontstaat bij 3% van de patiënten bij een followup van dertig jaar. Bij ieder polikliniekbezoek moet de bloeddruk aan de rechterarm worden gemeten en bij een hypertensieve waarde tevens de bloeddruk aan de benen. De bloeddruk aan
de linkerarm kan laag zijn door lokale problemen in de linker
arteria subclavia en is dus geen goede maat voor hypertensie of
recoarctatie. De diagnostiek bestaat vervolgens uit dopplerecho-onderzoek en een CT- of MRI-scan. De behandeling is bij
voorkeur een ballondilatatie met eventueel een stentimplantatie.
Ook zonder recoarctatie wordt vaak hypertensie gevonden: tot
60-70% veertig jaar na chirurgie. De incidentie van late hypertensie is hoger naarmate de operatieleeftijd hoger is. Medicamenteuze behandeling is aangewezen. Ook als er alleen inspanningsafhankelijke hypertensie bestaat moet medicamenteuze
behandeling worden overwogen.
Coronairlijden is de belangrijkste doodsoorzaak bij patiënten
met een status na coarctatieresectie; agressieve primaire preventie van coronaire atherosclerose is aangewezen.
Aneurysmavorming in het operatiegebied komt vooral voor na
patch-aortaplastiek, maar kan ook na andere operatietechnieken
voorkomen. Na ballonangioplastiek ontstaat relatief vaak een
aneurysma. Screening hierop door middel van CT of MRI is
aangewezen. Aneurysmavorming komt ook voor in de aorta
ascendens en is dan doorgaans geassocieerd met een bicuspide
aortaklep.
Aortadissectie is vrij zeldzaam. Predisponerende factoren zijn
atherosclerose, persisterende hypertensie en dilatatie van de
aorta ascendens. Tijdens zwangerschap is het risico op het ontstaan van een dissectie verhoogd.
Cerebrovasculaire accidenten zijn eveneens een belangrijke
doodsoorzaak. Er bestaat een associatie met aneurysmata van de
cirkel van Willis en met persisterende hypertensie.
Uiteraard bepalen bijkomende afwijkingen, zoals aortaklepafwijkingen, mede de prognose.
Voor alle patiënten met een coarctatie, gecorrigeerd of ongecorrigeerd, is levenslange endocarditisprofylaxe noodzakelijk.
Veel kinderen met een pulmonalisklepstenose hebben vrijwel
geen klachten. Als er wel klachten zijn, betreft dit meestal snelle vermoeibaarheid tijdens inspanning. De rechterventrikelimpuls kan versterkt zijn en bij een belangrijke stenose is precordiaal een systolische ‘thrill’ te voelen ter hoogte van de tweede
intercostale ruimte links.
Bij auscultatie kenmerkt een valvulaire stenose zich vaak door
een ejectieklik direct na de eerste harttoon. Door de verlengde
ejectietijd van het rechter ventrikel is de tweede toon steeds
gespleten; deze splijting neemt toe met de ernst van de vernauwing. Het systolische geruis is het best hoorbaar hoog parasternaal links en heeft een crescendo-decrescendopatroon. Het
maximum valt steeds later naarmate de ernst van de stenose toeneemt. Bij de zuigeling kan een zeer ernstige stenose leiden tot
cyanose ten gevolge van een rechts-linksshunt op atriumniveau,
maar zelden tot decompensatie.
Het ECG toont bij een matige en ernstige stenose rechterventrikelhypertrofie. Bij ernstige stenosen treden soms repolarisatieveranderingen op, evenals rechteratriumdilatatie.
Op de voorachterwaartse X-thorax is het hart normaal of licht
vergroot. Door de poststenotische dilatatie van de hoofdstam
van de longslagader is er vaak een prominente conus pulmonalis zichtbaar. De longvaattekening is soms wat gereduceerd.
Bij echocardiografie zijn de verminderde beweeglijkheid en de
eventuele verdikking van de klepslippen zichtbaar, evenals de
diameter van de klepring, de poststenotische dilatatie van de
pulmonalisstam en de rechterventrikelhypertrofie. Met doppleronderzoek kan de gradiënt over de klep worden bepaald.
De hemodynamiek kan precies worden vastgelegd tijdens hartkatheterisatie, maar bij een geïsoleerde valvulaire stenose zal de
stenose in dezelfde sessie met behulp van ballondilatatie worden
behandeld.
44.9.1 Inleiding
Een valvulaire pulmonalisstenose is een relatief frequent voorkomende aangeboren hartafwijking. Er kan een soepele klep
zijn met fusie van commissuren, een bicuspide klep of een dysplastische klep met verdikte cusps. De afwijking leidt tot een
drukbelasting voor het rechter ventrikel. De drukbelasting geeft
aanleiding tot hypertrofie, hetgeen kan leiden tot een additionele infundibulaire pulmonalisklepstenose.
44.9.2 Klinische presentatie
44.9.3 Beloop en therapie
Patiënten met een geringe pulmonalisklepstenose (gradiënt < 50
mmHg) zijn meestal klachtenvrij. Tijdens de groei is er meestal
een lichte progressie. Follow-up is levenslang nodig, maar de
kans op progressie bij een volgroeid individu is klein.
Bij een matige pulmonalisklepstenose (gradiënt 50-80 mmHg)
44
407
CONGENITALE HARTZIEKTEN
komen niet vaak klachten voor. De kans op progressie van de
stenose is groter dan bij een geringe pulmonalisklepstenose. In
de meeste centra wordt een matige pulmonalisklepstenose
behandeld als ballondilatatie mogelijk is.
Bij een ernstige pulmonalisklepstenose kunnen moeheid, dyspnoe en soms angineuze klachten voorkomen. De levensverwachting verbetert door therapie, zodat behandeling in principe
altijd geïndiceerd is.
Ballondilatatie is de therapie van keuze (figuur 44.13). Soms is
chirurgische verwijding van de klepring met een transanulaire
patch of klepvervanging nodig (met bijvoorbeeld een homograft). Een valvotomie en/of transanulaire patch leiden in meer
of mindere mate tot een pulmonalisklepinsufficiëntie (PI). Deze
wordt aanvankelijk vaak goed verdragen, maar bij ernstige PI is
op lange termijn vaak een nieuwe interventie nodig (klepvervanging). Patiënten met een gecorrigeerde pulmonalisklepstenose moeten levenslang worden gecontroleerd.
Endocarditisprofylaxe is levenslang geïndiceerd.
44.9.4 Follow-up
Follow-up van patiënten met een onbehandelde pulmonalisklepstenose is gericht op controle van de verergering van de stenose. Het gaat in dat geval doorgaans om een geringe pulmonalisklepstenose. Een controlefrequentie van eenmaal in de drie tot
vijf jaar is voldoende.
Bij een behandelde pulmonalisklepstenose is de controle enerzijds gericht op het ontstaan van een recidiefstenose, anderzijds
op de gevolgen van PI en het ontstaan van een operatie-indicatie hiervoor. Een operatie-indicatie is er in elk geval bij een afname van het inspanningsvermogen en/of een progressieve dilatatie van het rechter ventrikel. Als de rechterventrikelfunctie ook
achteruitgaat, is men eigenlijk te laat.
Figuur 44.13 Lateraal doorlichtingsbeeld van een pulmonalisklepdilatatie.
De insnoering in de ballon geeft het niveau van de vernauwde klep aan.
44.10 Tetralogie van Fallot
44.10.1 Morfologie
De door Fallot beschreven combinatie van vier kenmerken –
pulmonalisklepstenose, ventrikelseptumdefect, overrijding van
de aorta, rechterventrikelhypertrofie – is eigenlijk het gevolg
van slechts één afwijking: een naar anterior en craniaal verplaatst uitstroomseptum (figuur 44.14). Door de deviatie van het
uitstroomseptum treedt geen fusie op met het musculaire septum en ontstaat een malalignment-VSD met de aortaklep. Hoe
ernstiger de deviatie, hoe nauwer de uitstroombaan van het rechter ventrikel en hoe meer de aorta naar rechts is verplaatst. De
rechterventrikelhypertrofie ontstaat als reactie op de hoge systeemdruk. Combinatie met stenosen op verschillende andere
niveaus komt veel voor: valvulair, met vaak hypoplasie van de
klepring, en supravalvulair.
Een rechts descenderende aorta komt voor in 25% van de gevallen. Bij een deletie op chromosoom 22q11 wordt regelmatig een
tetralogie van Fallot gezien.
44.10.2 Pathofysiologie
De ernst van de vernauwing van de rechterventrikeluitstroombaan bepaalt de klinische verschijnselen. Is de vernauwing
(nog) mild, zoals het geval kan zijn bij de jonge zuigeling, dan
is de pulmonale uitstroomweerstand nog lager dan de systeemvaatweerstand en is er nog overwegend een links-rechtsshunt.
De klinische verschijnselen zullen niet verschillen van die van
een klein tot matig groot VSD en het kind zal asymptomatisch
zijn (‘pink Fallot’). Bij een toenemende vernauwing wordt uiteindelijk de pulmonale uitstroomweerstand groter dan de sys-
Figuur 44.14 Anatomische kenmerken van een tetralogie van Fallot: ventrikelseptumdefect, subvalvulaire pulmonalisklepstenose en overrijding van
de aorta en rechterventrikelhypertrofie.
408
DEEL G CONGENITALE HARTAFWIJKINGEN, PERICARDZIEKTEN EN TUMOREN
teemweerstand en ontstaat een rechts-linksshunt met een afname van de longdoorbloeding en cyanose. In het extreme geval
van een totale obstructie (pulmonalisatresie) is er geen longdoorbloeding meer vanuit het hart en wordt de longcirculatie
volledig afhankelijk van het openblijven van de ductus arteriosus en van collaterale circulatie.
44.10.3 Klinische presentatie
De cyanose is afhankelijk van de mate van uitstroomobstructie.
Ze kan al vanaf de geboorte ontstaan, maar wordt meestal pas na
enkele weken duidelijk en is bijna altijd progressief tijdens de
groei. Cyanose leidt tot een verminderde inspanningstolerantie.
Op oudere leeftijd komen daarbij hoofdpijnklachten ten gevolge
van de polycytemie. Trommelstokvingers en -tenen ontstaan
vanaf de kleuterleeftijd. De kinderen gaan frequent hurken en
tijdens het slapen in knie-ellebooghouding liggen (squatting).
Daardoor stijgt de systeemvaatweerstand, neemt de rechtslinksshunt af en verbetert de longdoorbloeding. Typisch voor de
tetralogie van Fallot is de ‘cyanotische aanval’, die vooral bij
jonge kinderen kan voorkomen, zelfs bij zuigelingen die tevoren
niet of nauwelijks cyanotisch zijn. De oorzaak is een acute constrictie van de uitstroombaan van het rechter ventrikel, hetgeen
resulteert in een sterke afname van de longdoorbloeding en
progressieve hypoxemie. Dit leidt tot onrust en hyperactiviteit,
waardoor de zuurstofconsumptie stijgt en de ernst van de
hypoxemie verder toeneemt. Een vicieuze cirkel wordt op gang
gebracht met het ontstaan van metabole acidose, die gepaard
gaat met een daling van de systeemvaatweerstand en daardoor
met een nog verdere toename van de rechts-linksshunt. Een dergelijke aanval kan dodelijk zijn.
Het ECG toont rechterventrikelhypertrofie. Op de X-thorax is
het hart niet vergroot en ziet men de typische klompvorm,
‘coeur en sabot’, met een opgewipte hartpunt en een kleine of
ontbrekende conus pulmonalis. De longvaattekening is meestal
afgenomen, behalve bij oudere patiënten met veel collaterale
vaten. Bij een rechter aortaboog is de aortaknopimpressie zichtbaar aan de rechterkant van de trachea.
Bij echocardiografie ziet men rechterventrikelhypertrofie en het
malalignment-VSD met overrijding van de aorta (figuur 44.15).
Hartkatheterisatie en angiografie worden slechts op indicatie
verricht om de morfologie van de uitstroombaan en het kaliber
van de stam en de takken van de arteria pulmonalis in detail vast
te leggen. MRI-technieken kunnen worden aangewend om de
morfologie van de perifere pulmonalistakken beter te definiëren.
Vooral bij oudere patiënten is MRI zeer nuttig voor de kwantificering van de pulmonalisinsufficiëntie en de rechterventrikelfunctie na operatie.
44.10.4 Therapie
In alle gevallen is chirurgische behandeling geïndiceerd. De
aard en het tijdstip daarvan zijn afhankelijk van de individuele
situatie. Electieve correctie wordt bij voorkeur uitgevoerd tussen
de derde en zesde levensmaand.
Figuur 44.15 Lange-asopname bij een tetralogie van Fallot waar de overrijding van de aorta goed zichtbaar is.
Ao = aorta; LV = linker ventrikel; RV = rechter ventrikel.
Het VSD wordt met een patch gesloten, het infundibulum wordt
uitgeruimd en eventueel wordt een valvulotomie van de pulmonalisklep uitgevoerd. Vaak is de pulmonalisklepring te nauw en
wordt een transanulaire patch van het rechterventrikeluitstroomgebied naar de stam van de arteria pulmonalis aangelegd, wat
obligaat leidt tot een belangrijke pulmonalisinsufficiëntie.
Is er sprake van ernstige onderontwikkeling van de pulmonalistakken of van een atresie van de oorsprong van de arteria
pulmonalis, dan wordt eerst een aortopulmonale Gore-Tex-anastomose (gemodificeerde blalockshunt) aangelegd om de
longdoorstroming te verzekeren en om groei van de pulmonalistakken te bevorderen. De intracardiale correctie volgt dan op de
peuterleeftijd. Wanneer de pulmonalisstam en de beide pulmonalistakken niet aangelegd zijn, wordt de longcirculatie verzorgd via collaterale arteriën vanuit de aorta. In deze situatie
worden één of meer unifocalisatieoperaties uitgevoerd, waarbij
deze pulmonale collaterale systeemarteriën tot één pulmonalissysteem worden gereconstrueerd, met zo mogelijk later herstel.
Het optreden van een cyanotische aanval is een absolute indicatie voor chirurgische interventie. De behandeling van de aanval
zelf is gericht op verlaging van de zuurstofbehoefte in de vroege fase van motorische onrust en hyperpnoe door het geven van
morfine. Daarnaast moeten zuurstof en natriumbicarbonaat worden toegediend om de snel optredende respiratoire acidose te
bestrijden. Door de knieën op de borst te drukken (squatting)
wordt de perifere weerstand verhoogd, neemt de rechts-linksshunt af en verbetert de bloedstroom naar de longen. De vroege
operatiemortaliteit is minder dan 1-2%. In ongeveer 10% van de
gevallen is reoperatie geïndiceerd voor een residueel belangrijk
VSD of een restgradiënt in de uitstroombaan van het rechter
ventrikel.
44
409
CONGENITALE HARTZIEKTEN
44.10.5 Langetermijnresultaten
De chirurgische behandeling heeft geresulteerd in een 10-jaarsoverleving van 96%; dertig jaar na correctie is 85% van de
patiënten nog in leven. Ook bij patiënten van 40 jaar en ouder is
een totale correctie nog altijd de moeite waard gezien de huidige goede resultaten en het lage operatierisico van 3% in ervaren
handen. Van een ‘volledige’ correctie is echter nooit sprake. De
postoperatieve mortaliteit en morbiditeit worden in het algemeen bepaald door een combinatie van anatomische restafwijkingen, functionele afwijkingen van de ventrikels en elektrofysiologische stoornissen. Restafwijkingen bestaan uit restshunts,
restgradiënten over de uitstroombaan van het rechter ventrikel,
rechterventrikelaneurysma, pulmonalisklepinsufficiëntie, tricuspidalisklepinsufficiëntie, aortaklepinsufficiëntie en coronaire
problematiek. Een hemodynamisch belangrijk rest-VSD (Qp/Qs
> 1,5) moet worden gesloten. Een restpulmonalisklepstenose,
resulterend in een rechterventrikeldruk van 50% of meer van de
linkerventrikeldruk, moet ook worden gecorrigeerd. Een restpulmonalisklepstenose kan het gevolg zijn van het onvoldoende
uitruimen van het infundibulum, van een niet-optimale valvulotomie, van een recidiverende supravalvulaire of perifere stenose,
van een verlittekening op de aanhechting van de outflowpatch,
de pulmonalisstam en pulmonalistakken of op de insertieplaats
van eerdere aortopulmonale shunts. Voor de perifere takstenose(n) valt een ballondilatatie te overwegen, al of niet gevolgd
door plaatsing van een intravasculaire stent.
Na operatie bestaat vaak een belangrijke pulmonalisklepinsufficiëntie, die in de regel jarenlang goed wordt verdragen. De volumebelasting kan aanleiding geven tot een forse dilatatie van het
rechter ventrikel, met uiteindelijk een afname van de ejectiefractie en het optreden van rechterventrikelfalen (figuur 44.16).
De verhoogde einddiastolische druk in het rechter ventrikel kan
ook leiden tot het ontstaan van ventriculaire ritmestoornissen.
Vervanging van de pulmonalisklep bij symptomatische patiënten is duidelijk geïndiceerd, maar ook als er nog geen klachten
zijn wordt tegenwoordig vaak geadviseerd de pulmonalisklep te
vervangen als er ernstige pulmonalisklepinsufficiëntie en ernstige rechterventrikeldilatatie aanwezig zijn.
Omdat er ook nadelen kleven aan ‘vroege’ pulmonalisklepvervanging bij asymptomatische patiënten – de homograft of bioprothese die voor de vervanging wordt gebruikt heeft een
beperkte levensduur van gemiddeld twaalf jaar, zodat reoperaties noodzakelijk zijn en eventueel percutane klepimplantatie –
blijft de optimale timing voor de ingreep vooralsnog onduidelijk. Een extreem breed QRS-complex met een duur > 180 ms
gaat gepaard met een verhoogd risico op ventrikeltachycardieën,
ventrikelfibrilleren en acute hartdood. Bij aangetoonde ventrikeltachycardieën bestaat de behandeling uit optimaliseren van
de hemodynamiek – vaak pulmonalisklepvervanging – elektrofysiologische diagnostiek en zo mogelijk ablatie. Vaak zal ook
worden gekozen voor implantatie van een ICD.
44.11 Het univentriculaire hart en de
fontancirculatie
44.11.1 Morfologie
Bij patiënten met een tricuspidalisatresie ontbreekt de connectie
tussen het rechter atrium en het rechter ventrikel. Daardoor is er
een wisselende mate van hypoplasie van het rechter ventrikel.
Een atriumseptumdefect (vrijwel altijd van het secundumtype)
of een open foramen ovale is obligaat. Vrijwel altijd is er een
ventrikelseptumdefect. De ventriculoarteriële connectie kan
zowel concordant (aorta ontspringt uit het linker ventrikel) als
discordant zijn (aorta ontspringt uit het rechter ventrikel). De
doorgang naar de aorta en de longslagader kan al of niet vernauwd zijn.
44.11.2 Pathofysiologie
Door vermenging van bloed uit de systeemcirculatie en uit de
pulmonaalveneuze circulatie is er altijd enige mate van cyanose.
Het linker ventrikel pompt het bloed van beide circulaties en is
dus volumebelast. De zuurstofsaturatie in het linker atrium, en
daarmee ook in het linker ventrikel, de aorta en de arteria pulmonalis, wordt bepaald door de verhouding tussen de pulmonaalveneuze en systeemveneuze retour. Bij een geringe longdoorstroming zal de desaturatie ernstiger zijn dan bij een grote
longdoorstroming.
44.11.3 Klinische presentatie
Figuur 44.16 MR-angiogram van een postoperatieve tetralogie van Fallot.
De uitstroombaan van het rechter ventrikel (RVO) is ernstig verwijd.
LV = linker ventrikel; RV = rechter ventrikel.
De klinische presentatie is divers en hangt vooral af van de mate
van longdoorstroming en van het al of niet aanwezig zijn van
een restrictie op atriumniveau. Ontbreekt een obstructie naar de
longen of het lichaam, dan zal er bij de geboorte slechts een
lichte cyanose bestaan; in de daaropvolgende weken daalt de
longweerstand met progressieve decompensatie.
Bij een ernstige obstructie naar de longen (restrictief ventrikelseptumdefect of pulmonalisklepstenose) zal cyanose op de
voorgrond staan, vooral na het sluiten van de ductus arteriosus.
DEEL G CONGENITALE HARTAFWIJKINGEN, PERICARDZIEKTEN EN TUMOREN
410
Bij een ernstige obstructie naar de aorta zal de lichaamscirculatie in het gedrang komen, zeker bij een geassocieerde coarctatio
aortae, met het risico op cardiogene shock in de eerste levensdagen.
Tegenwoordig wordt de diagnose gesteld met behulp van transthoracaal echocardiografisch onderzoek. De afwezige rechtszijdige connectie, de grootte van het atriumseptumdefect, van het
ventrikelseptumdefect en van het rechter ventrikel, en ook de
ventriculoarteriële connectie kunnen worden afgebeeld. Met
dopplerechocardiografie kan men de functie van de kleppen en
eventueel aanwezige gradiënten meten.
Bij twijfel over de oorsprong van de longdoorstroming of bij
onzekerheid over veneuze connecties is diagnostische hartkatheterisatie aangewezen.
44.11.4 Therapie
Indien bij een pasgeborene de communicatie op atriumniveau
restrictief is, moet een ballonatrioseptostomie volgens Rashkind
worden verricht. Is de longcirculatie te klein – bijvoorbeeld door
een pulmonalisklepstenose of een restrictief ventrikelseptumdefect – dan zal kort na de geboorte een aortopulmonale shunt
moeten worden aangelegd. Bij een niet-restrictieve toegang tot
de longcirculatie kan deze worden verminderd door het (chirurgisch) aanleggen van een bandje rond de stam van de arteria pulmonalis. Hiermee wordt tevens irreversibele pulmonale hypertensie voorkomen.
De definitieve behandeling is altijd chirurgisch, met als uiteindelijk doel het verkrijgen van een gescheiden long- en systeemcirculatie type Fontan (figuur 44.17). Er is slechts één adequaat
ventrikel voorhanden dat de systeemcirculatie moet verzorgen.
De essentie van de fontanoperatie is dat het zuurstofarme bloed
zonder hulp van een pompend ventrikel naar de longen wordt
geleid. De drijvende kracht achter het functioneren van de fontancirculatie is de transpulmonale gradiënt: de druk in de venae
cavae vóór het pulmonale vaatbed en de druk in het linker atrium erna. Een lage weerstand over het pulmonale vaatbed is de
meest kritische factor.
44.11.5 Langetermijnresultaten van de
fontancirculatie
Een fontanoperatie is een definitieve vorm van palliatie voor
patiënten met een complexe hartafwijking bij wie geen biventriculaire correctie mogelijk is. De ‘klassieke’ operatie werd uitgevoerd bij patiënten met tricuspidalisatresie, maar het principe
van de ingreep – de systeemveneuze return passief de longslagader in laten stromen zonder pompend ventrikel – kan ook worden toegepast bij andere patiënten met complexe hartafwijkingen met slechts één functioneel ventrikel, zoals ‘double inlet left
ventricle’ of het hypoplastisch linkerhartsyndroom. Het begrip
‘fontan’ is dus niet een exacte diagnose, maar een verzamelnaam voor veel verschillende hartafwijkingen en operatietechnieken.
Het aantal volwassen patiënten met een fontanoperatie is gering.
In deze patiëntengroep komen frequent restletsels voor en
indien die niet adequaat worden behandeld, zijn de morbiditeit
en de mortaliteit aanzienlijk. In de loop der jaren zijn de chirurgische technieken voortdurend veranderd en bij elke techniek
ontstaan mogelijk techniekspecifieke restafwijkingen.
Klinisch beeld. De klinische presentatie van een goede fontancirculatie zijn een beperkte inspanningstolerantie, maar verder
weinig klachten, en bij lichamelijk onderzoek een licht verhoogde centraalveneuze druk en een palpabele lever van 1-2 cm
onder de ribbenboog. Een verdere toename van de centraalveneuze druk, vergroting van de lever en verminderde inspanningstolerantie zijn uitingen van een verslechtering van de fontancirculatie. Bij een verslechtering van de hemodynamische
condities ontstaan bij patiënten met oudere circuits vaak ritmestoornissen, maar ritmestoornissen kunnen ook de oorzaak zijn
van de verslechtering. Atriumfibrilleren komt het meest voor en
wordt vaak slecht verdragen. De chyleuze drainage – de ductus
thoracicus mondt uit in het veneuze systeem dat nu een verhoogde druk heeft – kan gestoord zijn en dat kan leiden tot
eiwitverlies in de darmen. Patiënten bij wie deze ‘proteinlosing enteropathy’ ontstaat hebben een zeer slechte prognose.
Door de verhoogde systeemveneuze drukken kan de systeemveneuze retour uit de benen bemoeilijkt zijn, hetgeen leidt tot
chronische stuwing en spataderen in de onderbenen. De combiFiguur 44.17 Stapsgewijze
aanleg van een fontancirculatie.
a De techniek is hier toegepast
bij een tricupidalisklepatresie.
b De aanleg van een partiële
cavopulmonale connectie, waarbij de vena cava superior endto-side op de rechter arteria
pulmonalis wordt aangesloten.
c De gecompleteerde totale
cavopulmonale connectie, waarbij het bloed uit de vena cava
inferior door of langs het hart
getunneld de rechter arteria
pulmonalis bereikt.
a
b
c
44
411
CONGENITALE HARTZIEKTEN
natie van een verminderd hartminuutvolume en veneuze congestie leidt vaak tot een slechte perifere circulatie en tot trofische huidstoornissen.
44.11.6 Therapie en prognose
Bij een goede fontancirculatie worden meestal geen medicijnen
gegeven ter ondersteuning van de hemodynamiek. Bij atriumfibrilleren en reeds doorgemaakte trombo-embolische complicaties zullen orale anticoagulantia worden voorgeschreven. Over
het nut van orale anticoagulantia voor alle fontanpatiënten ter
voorkoming van pulmonale embolieën zijn de meningen verdeeld.
Wanneer de klinische conditie achteruitgaat, moet de precieze
oorzaak worden onderzocht omdat enkele van de oorzaken
behandelbaar zijn. Dergelijke problemen kunnen het best actief
worden opgespoord en behandeld voordat ze problematisch
worden. Vaak is hiervoor invasieve diagnostiek nodig, in de
vorm van hartkatheterisatie. Verhoging van de pulmonale weerstand als gevolg van een lokale stenose kan worden behandeld
met een reoperatie of met percutane stentimplantatie. Soms is
conversie van een ‘oude’ fontantechniek, zoals een connectie
tussen rechter atrium en rechter ventrikel of tussen rechter atrium en arteria pulmonalis, naar een modernere intra- of extracardiale tunnel aangewezen. Als de verhoging van de pulmonale weerstand wordt veroorzaakt door longembolieën moet de
patiënt op orale anticoagulantia worden ingesteld. Bij klinische
achteruitgang als gevolg van een verhoging van de linkeratriumdruk door een verslechtering van de ventrikelfunctie, kan
medicamenteuze therapie worden overwogen, maar de mogelijkheden zijn beperkt: ACE-remmers worden vaak slecht verdragen en er is weinig ervaring met bètablokkers. Een lage dosering diuretica is vaak effectief. Hogere doseringen worden
slecht verdragen omdat bij een afname van de veneuze stuwing
de transpulmonale gradiënt minder wordt. Uiteindelijk is harttransplantatie de laatste optie. Als de pulmonale weerstand
zodanig hoog is dat een fontancirculatie onmogelijk is, is de
weerstand vaak ook borderline hoog voor een harttransplantatie.
De maximale follow-up na een fontanoperatie is dertig jaar.
Daarom is over de prognose nog niets met zekerheid te zeggen,
ook niet over de prognose van de kleine groep patiënten met een
perfect functionerende fontanconstructie. Waarschijnlijk is de
levensverwachting voor deze patiënten gereduceerd.
44.12 Transpositie van de grote vaten
44.12.1 Morfologie
Bij een transpositie van de grote vaten ontspringt de aorta uit het
rechter ventrikel en de arteria pulmonalis uit het linker ventrikel
(complete transpositie van de grote vaten). In ongeveer 50% van
de gevallen zijn er bij een transpositie van de grote vaten bijkomende afwijkingen zoals een ventrikelseptumdefect of een pulmonalisstenose.
44.12.2 Pathofysiologie
Bij een transpositie van de grote vaten zijn de long- en lichaamscirculatie gescheiden: het systeemveneuze bloed wordt weer
naar het lichaam geleid en het pulmonaalveneuze bloed weer
naar de longen (figuur 44.18). Vóór de geboorte heeft dit in
principe geen consequenties. Na de geboorte kan zuurstofrijk
bloed de systeemcirculatie alleen bereiken indien het foramen
ovale openblijft; de efficiëntie van deze links-rechtsshunt is verFiguur 44.18 a Circulatieschema bij een normale stand van
de grote vaten, met in serie
geschakelde long- en lichaamscirculatie. b De parallel geschakelde long- en lichaamscirculatie bij een transpositie van de
grote vaten.
a
b
412
DEEL G CONGENITALE HARTAFWIJKINGEN, PERICARDZIEKTEN EN TUMOREN
hoogd bij een open ductus, waardoor een relatieve longovercirculatie ontstaat. De arteriële zuurstofverzadiging wordt direct na
de geboorte dan ook volledig bepaald door deze mogelijkheid
van shunting. Met het dalen van de longvaatweerstand neemt de
longveneuze terugvloed naar het linker atrium toe, en daarmee
ook de links-rechtsshunt door het foramen ovale. Door de toename van de arteriële zuurstofverzadiging direct na de geboorte
treedt constrictie en eventueel sluiting van de ductus arteriosus
op. Dit kan resulteren in snel progressieve cyanose, hypoxie en
acidose.
Zijn er bijkomende afwijkingen, zoals een VSD, dan wordt de
pathofysiologie mede daardoor bepaald.
44.12.3 Klinische presentatie
Meestal is er sprake van progressieve cyanose vanaf de geboorte, tenzij er ook een groot VSD aanwezig is. Indien de cyanose
snel wordt herkend, verkeert het kind doorgaans nog in goede
conditie omdat de shuntmogelijkheid nog adequaat is. Deze
situatie kan echter acuut en onvoorspelbaar veranderen en aanleiding geven tot ernstige hypoxemie, metabole acidose en
decompensatio cordis.
Naast de cyanose zijn er vaak geen andere afwijkingen waarneembaar; meestal is er geen geruis en is het ECG normaal. De
klassieke bevinding op de X-thorax is een hartvorm als een ei op
zijn kant en een smalle vaatsteel. Dit is echter vaak niet aanwezig.
Echocardiografie bevestigt de abnormale oorsprong van de twee
grote arteriën, evenals de mogelijkheden voor shunting (figuur
44.19). Hierbij speelt vooral de grootte van het foramen ovale
een cruciale rol. De shuntmogelijkheid bepaalt direct het te volgen beleid. Diagnostische hartkatheterisatie en angiocardiografie worden niet meer routinematig verricht.
44.12.4 Therapie
Bij de ongecompliceerde transpositie van de grote vaten (geen
additionele afwijkingen) is het creëren of het onderhouden van
een adequate shuntmogelijkheid vitaal. Intraveneuze toediening
van prostaglandine E1 resulteert in een snelle opening van de
ductus arteriosus en daarmee in een toename van de longdoorbloeding. Hierop neemt de arteriële zuurstofverzadiging in het
algemeen snel toe. Indien het foramen ovale restrictief is, kan
een atriumballonseptostomie volgens Rashkind worden verricht. Bij ernstige cyanose direct na de bevalling kan een levensreddende shunt worden verkregen door het plaatsen van een ‘te
diepe’ navelkatheter. Via de klep van Eustachius zal een dergelijke katheter het foramen ovale meestal ‘op een kier’ zetten.
Nadat op die manier de klinische situatie is gestabiliseerd, moet
in de eerste levensdagen chirurgische behandeling worden uitgevoerd. Tijdens de operatie wordt een arteriële ompoling
(arteriële switch) uitgevoerd, waarbij de aorta en de arteria pulmonalis worden ‘omgewisseld’. De coronaire arteriën worden
gere-implanteerd in de neoaorta. Tevens worden de ductus
gekliefd en het atriumseptumdefect gesloten (figuur 44.20).
Figuur 44.19 Parallelle stand van de aorta (Ao) en de arteria pulmonalis
(AP) bij een transpositie van de grote vaten.
In het verleden werd een veneuze ompolingsoperatie volgens
Mustard of Senning verricht. Hierbij verwijderde men het atriumseptum en werd een patch zodanig ingehecht dat het systeemveneuze bloed naar het linker ventrikel werd geleid, en het
longveneuze bloed naar het rechter ventrikel (atriale switch;
figuur 44.21). In zo’n situatie blijft het rechter ventrikel de systeemventrikel.
Indien er tevens sprake is van een groot VSD, staat de cyanose
veel minder op de voorgrond. Bij deze kinderen ontstaan de problemen in het algemeen ook wat later, meestal in de tweede of
soms zelfs in de derde levensmaand. Bij hen zal dan ook een
arteriële ompolingsoperatie worden uitgevoerd met simultane
sluiting van het VSD.
Is er tevens sprake van een pulmonalisstenose, dan is een arteriële ompolingsoperatie niet mogelijk. In dat geval komt een
complexere ingreep in aanmerking, zoals die volgens Rastelli.
Daarbij wordt het VSD zodanig gesloten dat het linker ventrikel
naar de aorta draineert. Het pulmonalisostium wordt gesloten en
er wordt een klephoudende homograft geplaatst tussen het rechter ventrikel en de arteria pulmonalis.
44
413
CONGENITALE HARTZIEKTEN
Figuur 44.20 Arteriële ompolingsoperatie (switch). a De aorta en de arteria pulmonalis worden doorgenomen. b Er worden twee klapdeurincisies
gemaakt in de arteria pulmonalis net boven klepniveau (neoaortawortel).
c De coronaire arteriën worden ruim geëxcideerd en geïmplanteerd in de
neoaortawortel. d De aorta ascendens wordt achter de pulmonalisbifurcatie
gebracht en geanastomoseerd met de neoaorta. Ook de nieuwe arteria pulmonalis wordt gecreëerd, waarbij de defecten met patches worden gesloten.
voerd. Daarbij wordt de transpositiestand van de grote vaten
ongemoeid gelaten: de longslagader ontspringt uit het linker
ventrikel en de aorta uit het rechter ventrikel. Het belangrijkste
probleem op volwassen leeftijd is dat het rechter ventrikel, dat
in deze circulatie als systeemventrikel werkt, op relatief jonge
leeftijd in functie achteruit kan gaan. Het ventrikel dilateert en
secundair aan deze dilatatie, die ook dilatatie van de tricuspidalisanulus tot gevolg heeft, ontstaat tricuspidalisinsufficiëntie.
Andere problemen zijn supraventriculaire ritmestoornissen –
een gevolg van de uitgebreide chirurgie op atriumniveau – en
vernauwing of lekkage van de ‘baffles’ (de chirurgisch aangelegde tunnels).
Bij hartfalen zijn de mogelijkheden beperkt. Het effect van
ACE-remmers of bètablokkers is nog onduidelijk bij personen
bij wie het rechter ventrikel fungeert als systeemventrikel.
Doorgaans is harttransplantatie de enige optie. De uitgebreide
atriale chirurgie leidt tot veel littekenweefsel; rond een litteken
komen frequent intra-atriale re-entrytachycardieën voor. Verlies
van de sinusknoopfunctie is ander veelvoorkomend gevolg van
de atriale chirurgie; bij sinusknoopdisfunctie is in veel gevallen
pacemakerimplantatie noodzakelijk.
Een ‘baffle’-stenose kan vaak goed worden behandeld met stentimplantatie.
44.13 Congenitaal gecorrigeerde transpositie van
de grote vaten
44.12.5 Langetermijnresultaten
Arteriële switch. De arteriële ompolingsoperatie heeft in de neonatale fase een lage mortaliteit (< 1-2%). De eerste middellangetermijnresultaten zijn veelbelovend, met beperkte en weinig
frequente complicaties. Soms is reoperatie nodig doordat er een
supravalvulaire pulmonalisstenose op de anastomose of in de
pulmonalistakken ontstaat. Progressieve dilatatie van de neoaortawortel kan aanleiding geven tot aortaklepinsufficiëntie waarvoor soms klepvervanging nodig is. Daarnaast is een coronaire
obstructie beschreven die leidt tot een myocardinfarct of ventrikeldisfunctie.
Atriale switch. Tot 20 à 25 jaar geleden werd bij de pasgeborenen – nu volwassenen – een veneuze ompolingsoperatie uitge-
44.13.1 Morfologie
De congenitaal gecorrigeerde transpositie van de grote vaten, in
het verleden ook L-transpositie genoemd, is een zeldzame
afwijking (1% van de aangeboren afwijkingen). Karakteristiek
is de discordante connectie, zowel atrioventriculair als ventriculoarterieel (figuur 44.22). Daardoor staat het rechter atrium via
de mitralisklep in verbinding met het rechts gelegen linker ventrikel, en het linker atrium via de tricuspidalisklep met het links
gelegen rechter ventrikel. Deze inversie van de ventrikels wordt
hemodynamisch ‘gecorrigeerd’ door de positie van de grote
Figuur 44.21 Atriale ompolingsoperatie volgens Mustard.
a Het systeemveneuze bloed
stroomt via de patch naar het
mitralisostium.
b Het longveneuze bloed
stroomt via de patch naar het
tricuspidalisostium.
Ao
SVC
PA
SVA
PVA
M
Ao = aorta; IVC = vena cava inferior;
TR
LV = linker ventrikel; M = mitralis-
LV
klep; PA = arteria pulmonalis; PVA =
pulmonaalveneus atrium; RV = rech-
RV
IVC
ter ventrikel; SVA = systeemveneus
atrium; SVC = vena cava superior;
TR = tricuspidalisklep.
a
b
414
DEEL G CONGENITALE HARTAFWIJKINGEN, PERICARDZIEKTEN EN TUMOREN
zeer kwetsbaar, hetgeen frequent leidt tot het ontstaan van een
AV-blok, wat in 20% van de gevallen al bij de geboorte aanwezig is.
44.13.3 Klinische presentatie
Figuur 44.22 Anatomische kenmerken van een dubbel discordant hart,
zowel atrioventriculair als ventriculoarterieel.
Ao = aorta; LA = linker atrium; LV = linker ventrikel; AP = arteria pulmonalis; RA =
rechter atrium; RV = rechter ventrikel; TRIC = tricuspidalisklep.
vaten: de arteria pulmonalis ontspringt uit het linker ventrikel en
de aorta uit het rechter ventrikel. De aorta staat in transpositiestand vóór en links parallel aan de arteria pulmonalis. De circulatie verloopt dus normaal: het zuurstofarme bloed bereikt uiteindelijk de longen, weliswaar via het linker ventrikel, en het
zuurstofrijke bloed bereikt het lichaam via het rechter ventrikel.
Het rechter ventrikel is echter het hogedruk-systeemventrikel,
het linker ventrikel het lagedruk-pulmonale ventrikel. Kenmerkend voor de afwijking is het abnormale geleidingssysteem. De
normale AV-knoop vindt geen contact met de rest van de conductieas. Er is een meer anterior gelegen additionele AV-knoop
aanwezig, die de bundel van His afgeeft met een langer dan
normaal traject en verder zeer oppervlakkig in een subendocardiale positie descendeert aan de rechterkant van het ventrikelseptum als linker bundeltak. De coronaire vaten takken
eveneens spiegelbeeldig af. Dextrocardie komt in 25% van de
gevallen voor.
Een geïsoleerde ‘gecorrigeerde transpositie’ veroorzaakt geen
klachten. Geassocieerde letsels zoals een VSD of pulmonalisstenose zullen de aandacht trekken bij de zuigeling. Een patiënt
kan zich presenteren met een trage hartslag of symptomatische
bradycardie (progressief AV-blok waardoor onder andere vertigo, syncope ontstaan), decompensatie door rechterventrikeldisfunctie of progressieve tricuspidalisklepinsufficiëntie op elke
leeftijd. Karakteristiek is de luide, ongespleten tweede toon. Het
ECG zal de typische kenmerken vertonen van de spiegelbeeldige distributie van het geleidingssysteem met een omgekeerd
verloop van de septale depolarisatie: q aanwezig in V1, afwezig
in V6. Verder vindt men een linker QRS-asdeviatie en een kloksgewijze rotatie van de QRS-lus in het frontale vlak. Een karakteristieke bevinding op de X-thorax is de rechte aflijning van de
linker hilus door de naar links verplaatste aorta ascendens.
Echocardiografie is diagnostisch. Identificatie van elk ventrikel
is gebaseerd op enkele fundamentele verschillen tussen beide.
Zo is een rechter ventrikel te herkennen aan de lagere insertie
van de tricuspidalisklep op het septum ten opzichte van de mitralisklep, aan zijn grove trabekels met de aanwezigheid van een
moderatorband, aan de discontinuïteit tussen de morfologisch
links gelegen tricuspidalisklep en de pulmonalisklep. Door de
hogere insertie van de rechts gelegen mitralisklep is het bijbehorende ventrikel te identificeren als een linker ventrikel. Dit
ventrikel is ook te herkennen aan zijn fijne reliëf en aan de continuïteit tussen de rechts gelegen mitralisklep en de pulmonalisklep. Op een korte-asopname bevindt de aorta zich links anterior
van de arteria pulmonalis.
44.13.4 Therapie
Een gecorrigeerde transpositie van de grote vaten zonder bijkomende afwijkingen is zeldzaam. Meestal vindt men een geassocieerd VSD (70%), al of niet in combinatie met een subvalvulaire, valvulaire pulmonalisstenose (30-50%), en een anomalie
van de tricuspidalisklep (90%) waaronder de ebsteinmalformatie. Deze klassieke triade komt zo frequent voor dat ze als intrinsiek element van de aandoening kan worden beschouwd.
44.13.2 Pathofysiologie
Een dubbele discordantie zonder bijkomende afwijkingen kan
compatibel zijn met een normale levensverwachting. De afwijking wordt soms bij toeval ontdekt op 80-jarige leeftijd. De normale circulatie zal verstoord raken door de aanwezigheid van
een shunt of van een obstructie. Het rechter ventrikel is systeemventrikel, waarbij het risico bestaat op vroegtijdig disfunctioneren met progressieve tricuspidalisklepinsufficiëntie. Het
abnormaal lange en superficieel gelegen geleidingssysteem is
De patiënt met een dubbele discordantie zonder bijkomende
afwijkingen heeft een goede prognose op middellange termijn
en behoeft geen therapie. Wel is follow-up noodzakelijk omdat
soms een totaal AV-blok ontstaat waarvoor DDD-pacing noodzakelijk is. Op termijn kan tevens het rechter systeemventrikel
falen. Ook in de situatie van een geassocieerd VSD en pulmonalisstenose met een uitgebalanceerde circulatie kan worden
overwogen niet in te grijpen indien er geen klachten zijn. Ter
preventie van irreversibele pulmonale hypertensie moet een
VSD met een grote links-rechtsshunt worden gesloten. Door de
moeilijke toegangsweg tot het VSD en de gevaarlijke ligging
van het geleidingssysteem is deze ingreep niet zonder risico.
Ook de anatomie van de pulmonalisstenose, zowel tunnelvormig subvalvulair als valvulair, is een probleem met een groot
risico op het ontstaan van een totaal AV-blok. Er wordt dan ook
bij voorkeur gekozen voor een uitwendige overbrugging van het
gestenoseerde segment door middel van een klephoudende
conduit (homograft).
44
415
CONGENITALE HARTZIEKTEN
In de loop der jaren is gebleken dat deze klassieke ingrepen dikwijls een zeer slechte invloed hadden op de functie van de tricuspidalisklep, met versneld optreden van ernstige insufficiëntie. Een optie is dan ook een ‘dubbele switch’-operatie ofwel
een operatie volgens Rastelli-Senning uit te voeren om de tricuspidalisklep te sparen. Voorwaarde voor het slagen van een
dergelijke ingreep is dat het linker ventrikel voorbereid moet
zijn op zijn werk als hogedruk-systeemventrikel en dat ter voorbereiding hiertoe het plaatsen van een bandje rond de arteria
pulmonalis in verschillende tempi noodzakelijk kan zijn. Dit
trainen is slechts op zeer jonge leeftijd mogelijk. Is de kinderleeftijd eenmaal voorbij, dan blijkt uit ervaring dat het linker
ventrikel niet meer te ‘trainen’ is! In de komende jaren zal blijken of de theoretische voordelen van een dergelijke ingewikkelde procedure in de praktijk zullen worden bevestigd.
Op de kinderleeftijd is hartfalen zeldzaam. Vanaf jongvolwassen
leeftijd neem het percentage patiënten met hartfalen geleidelijk
toe. Op de leeftijd van 50 jaar heeft slechts 10% van de patiënten géén hartfalen. Als er een ernstige tricuspidalisklepinsufficiëntie bestaat bij dilatatie van het rechter ventrikel, en als de
functie van het rechter ventrikel duidelijk is verminderd, met een
ejectiefractie < 40%, wordt afgeraden deze klep te vervangen. Is
de rechterventrikelfunctie nog wel goed, met een ejectiefractie
van > 50%, dan wordt aangeraden de klep wel te vervangen. Een
klepplastiek is zelden succesvol. Bij een ejectiefractie tussen 40
en 50% is de keuze onduidelijk.
Bij rechterventrikelfalen wordt in de praktijk dezelfde medicamenteuze behandeling gegeven als bij linkerventrikelfalen,
maar er zijn geen data die aangeven dat ACE-remmers en bètablokkers in deze specifieke situatie ook effectief zijn. Plotse
dood komt relatief veel voor in deze populatie. Aanvankelijk
werd dit toegeschreven aan een progressief AV-blok, maar
tegenwoordig wordt gedacht dat vooral ventrikeltachycardieën
of ventrikelfibrilleren bij een slechte ventrikelfunctie de oorzaak
zijn. Ook bij deze patiënten wordt steeds vaker implantatie van
een ICD geadviseerd.
Figuur 44.23 Schematische weergave van de morfologie van de ziekte van
Ebstein.
LA = linker atrium; LV = linker ventrikel; RA = rechter atrium; RV = rechter
ventrikel.
sisterend foramen ovale (PFO) (50%), pulmonalisklepstenose of
-atresie, een ventrikelseptumdefect (VSD) en een congenitaal
gecorrigeerde transpositie.
De primaire hemodynamische afwijking is tricuspidalisinsufficiëntie. Ernstige tricuspidalisinsufficiëntie veroorzaakt dilatatie
van het rechter hart, een verminderd hartminuutvolume en hepatomegalie. Bij een hoge rechteratriumdruk kan zich centrale
cyanose ontwikkelen door een rechts-linksshunt via een PFO of
ASD. Uitbochting van het ventrikelseptum naar links kan de
geometrie van het linker ventrikel en daarmee de linkerventrikelfunctie verstoren.
De ziekte van Ebstein komt met 0,3-0,8% van de aangeboren
hartafwijkingen sporadisch voor. Hierbij wordt in 30% van de
gevallen een wolff-parkinson-whitesyndroom gevonden. Het
risico op een kind met een aangeboren hartafwijking bij ouders
van wie één een ebsteinmalformatie heeft, is 4%. Indien de
moeder de ziekte heeft, is het herhalingsrisico 6%, en indien de
vader de ziekte heeft is dit 1%.
44.14 Ebsteinmalformatie van de tricuspidalisklep
44.14.2 Klinische verschijnselen
44.14.1 Inleiding
De tricuspidalisklep ontstaat doordat de binnenlaag van het
rechter ventrikel wordt ondermijnd, als het ware loskomt en de
klepbladen vormt (figuur 44.23). Bij de ziekte van Ebstein is aan
dit proces vroegtijdig een eind gekomen waardoor een groter of
kleiner deel van septale en inferiore klepbladen vergroeid is
gebleven met de rechterventrikelwand (het anterior klepblad is
niet verplaatst, is groot en kan fenestraties vertonen). Soms is er
geen klep wanneer deze volledig adherent is gebleven. Het deel
van het rechter ventrikel dat nu tot het rechter atrium behoort,
wordt het geatrialiseerde gedeelte van het rechter ventrikel
genoemd.
De ebsteinmalformatie kan samengaan met accessoire geleidingsbundels (25%), een atriumseptumdefect (ASD) of een per-
De klinische presentatie is in alle leeftijdscategorieën zeer gevarieerd. De ernstigste vorm leidt al zeer vroeg tot grote problemen zoals hydrops foetalis, met als gevolg intra-uteriene vruchtdood of overlijden vroeg na de geboorte. Daarnaast is overleving zonder noemenswaardige problemen tot een leeftijd van 80
jaar niet uitzonderlijk. Indien de ziekte al manifest is bij de pasgeborene, kan de presentatie zeer dramatisch zijn: de combinatie
van tricuspidalisklepinsufficiëntie en een nog verhoogde pulmonale vaatweerstand kan leiden tot ernstig rechtsfalen waardoor
een ernstige diepe cyanose ontstaat. Bij het kind of de adolescent
wordt de afwijking meestal ontdekt doordat een hartgeruis te
horen is, bij de volwassene trekt een tachycardie de aandacht.
Ofschoon sommige patiënten beweren geen klachten te hebben,
zal de meerderheid toch dyspnoe vertonen, vroegtijdige vermoeidheid of palpitaties. Paradoxale embolisatie neemt toe met
de leeftijd.
DEEL G CONGENITALE HARTAFWIJKINGEN, PERICARDZIEKTEN EN TUMOREN
416
Adolescenten en volwassenen met de ziekte van Ebstein zijn
meestal asymptomatisch omdat de ernstige vormen al min of
meer uitgeselecteerd zijn. Symptomen worden veroorzaakt door
ernstige tricuspidalisklepinsufficiëntie en rechterventrikeldisfunctie of door centrale cyanose. Palpitaties door supraventriculaire ritmestoornissen komen frequent voor.
De centraalveneuze druk is zelden verhoogd. De eerste toon is
wijd gespleten met een luide tricuspidaliscomponent. De tweede toon is wijd gespleten door een rechterbundeltakblok
(RBTB). Soms is er een derde toon. Het systolische, bij inspiratie luider wordend tricuspidalisinsufficiëntiegeruis is evident.
De bevindingen op het ECG variëren sterk. Kenmerkend zijn
lage ventrikelvoltages en hoge rechteratriumvoltages. Het PRinterval kan verlengd zijn, maar soms ook kort door pre-excitatie. Er is een variabel RBTB. Op de X-thorax kan het hart sterk
vergroot zijn, met uitbochting van de rechter contour. De longvaattekening is meestal normaal of verminderd. Met echocardiografie zijn de apicale verplaatsing van het septale blad en de andere typische kenmerken te zien, met kleurendoppleronderzoek de
tricuspidalisklepinsufficiëntie. Voor de lokalisatie van accessoire
bundels is soms elektrofysiologisch onderzoek nodig.
De follow-up moet plaatsvinden in centra die zijn gespecialiseerd in aangeboren hartafwijkingen.
44.14.3 Chirurgische behandeling
Indicaties voor chirurgische interventie zijn een verslechtering
van de functionele capaciteit (NYHA > III), progressieve cyanose, (rechtszijdig) hartfalen, het optreden van een paradoxale
embolie, recidiverende supraventriculaire ritmestoornissen
ondanks medicamenteuze of ablatietherapie, en asymptomatische progressieve cardiomegalie. Een klepplastiek (vroege mortaliteit 6,1-9%) en plicatie van het geatrialiseerde gedeelte van
het rechter ventrikel kunnen worden uitgevoerd, en een eventueel PFO of ASD wordt gesloten. Zelden is het nodig dat de tricuspidalisklep wordt vervangen. Indien het slagvolume van het
rechter ventrikel zeer beperkt is, moet soms een partiële of zelfs
een totale cavopulmonaire connectie worden aangelegd; men
spreekt dan respectievelijk over een 1,5 ventrikelcircuit of een
fontancirculatie.
44.15 Marfansyndroom
44.15.1 Inleiding
Het marfansyndroom is een autosomaal dominant overervende
bindweefselziekte met karakteristieke manifestaties in vooral
hart, grote vaten, ogen, hersenvliezen en skelet. Progressieve
dilatatie van de aorta ascendens is een van de belangrijkste verschijnselen, waardoor patiënten met het marfansyndroom al op
jonge leeftijd het risico lopen op plotse dood door aortadissectie of -ruptuur. De prevalentie wordt geschat op 1:5000, waarvan
de meerderheid familiair is, maar ongeveer 15-30% wordt veroorzaakt door nieuwe mutaties. Het onderliggende genetische
defect is gelokaliseerd in het fibrillinegen (FBN-1) op chromosoom 15, waar de mutaties in het fibrillinegen echter kunnen
variëren. Met behulp van moleculairbiologisch onderzoek kan
Tabel 44.2 Diagnostische criteria voor het syndroom van Marfan.
harde criteria
zachte criteria
familieanamnese
genetisch onderzoek
hart en grote vaten
ouder, kind, broer of zus
mutatie FBN-1
aortaworteldilatatie
dissectie aorta ascendens
–
oog
skelet
lens (sub)luxatie
(≥ 4)1: pectus carinatum, ernstige pectus
excavatum, pols-duimteken, scoliose > 20°,
hoge gehemelteboog, arm-spanlengteratio
> 1,05, protrusio acetabulae, verminderde
extensie ellebogen (< 170°)
long
huid
–
–
dura
lumbosacrale ectasie op MRI- of CT-scan
mitralisklepprolaps
calcificatie mitralisanulus < 40 jaar
dilatatie arteria pulmonalis
dilatatie/dissectie aorta descendens < 50 jaar
(≥ 2)2: platte cornea, myopie, vergrote lengteas oogbol
(≥ 2 harde criteria of 1 hard + 2 zacht)3: hypermobiliteit,
kenmerkend gelaat
spontane pneumothorax
striae
recidiverende herniae
–
1 Ten minste vier kenmerken moeten aanwezig zijn voor er sprake is van een hard criterium.
2 Ten minste twee kenmerken moeten aanwezig zijn voor er sprake is van een zacht criterium.
3 De aanwezigheid van ten minste twee kenmerken uit de lijst ‘harde criteria’ vormt één zacht criterium. De aanwezigheid van één kenmerk uit de lijst ‘harde criteria’
en twee kenmerken uit de lijst ‘zachte criteria’ is ook voldoende om te spreken van een zacht criterium.
44
417
CONGENITALE HARTZIEKTEN
de diagnose worden bevestigd, maar nog niet routinematig. De
diagnose en het beleid bij marfanpatiënten dient vooralsnog op
grond van klinische verschijnselen te worden bepaald.
Een multidisciplinair team is nodig voor het stellen van de diagnose en de screening van familieleden. De diagnose marfansyndroom wordt gebaseerd op verschillende fenotypische manifestaties in het gehele lichaam en op de familieanamnese. In 1995
zijn de diagnostische criteria bijgesteld (tabel 44.2). Voor het
stellen van de diagnose is de aanwezigheid van een hard criterium in twee verschillende orgaansystemen en een (eventueel
geringe) manifestatie in een derde orgaansysteem noodzakelijk.
44.15.2 Medicamenteuze therapie en beleid
De dilatatie van de aorta begint meestal in de aorta ascendens en
heeft als voorkeurslokalisatie de sinus Valsalvae (figuur 44.24).
Type-A-dissectie van de aorta is de belangrijkste doodsoorzaak
bij patiënten met het marfansyndroom (60%). Door de verbeterde medicamenteuze en chirurgische behandeling is de levensverwachting de laatste twintig jaar aanzienlijk toegenomen tot
gemiddeld zestig jaar in 1993. Het risico op dissectie van de
aorta neemt toe met de diameter van de aortawortel en is beduidend hoger bij patiënten met een familielid bij wie een dissectie
is opgetreden.
Dilatatie van de aortawortel ontstaat geleidelijk: gemiddeld
1-2 mm per jaar. Behandeling met bètablokkers zou de dilatatie
vertragen en het risico op dissectie verlagen. Topsport, isometrische sporten en contactsporten moeten worden ontraden.
Voor vrouwen met het marfansyndroom is zwangerschap in
twee opzichten een probleem: het genetische aspect (50% kans
op een kind met marfansyndroom) en een hoog risico (ongeveer
50%) op een aortadissectie bij de moeder tijdens en vooral kort
na de zwangerschap. Vrouwen met een aortadiameter > 45 mm
moet zwangerschap worden ontraden zonder voorafgaande elec-
tieve aortawortelvervanging. Een aortadiameter < 40 mm geeft
meestal weinig problemen, hoewel een veilige diameter niet
bestaat. Prenatale diagnostiek is in principe mogelijk als vóór de
zwangerschap moleculair onderzoek in de familie werd verricht
en informatief was.
44.15.3 Chirurgische behandeling
De belangrijkste reden om de aortawortel te vervangen is het
voorkómen van een dissectie. Echocardiografische follow-up van
de maximale aortaworteldiameter is derhalve van het grootste
belang om het tijdstip van operatie te bepalen. MRI- of CT-onderzoek van de gehele aorta is bij iedere patiënt met het marfansyndroom geïndiceerd, omdat 20% van de aortadissecties optreedt in
de abdominale aorta. Aortawortelvervanging wordt geadviseerd
bij een maximale diameter van 55 mm. Bij patiënten met een dissectie in de familie, een snelle groei van de aorta (> 2 mm/jaar) of
een ernstige aorta- of mitralisklepinsufficiëntie waarvoor chirurgie noodzakelijk is, wordt aortawortelvervanging geadviseerd bij
een maximale diameter van 50 mm. Bij vrouwen die zwanger willen worden en bij patiënten bij wie een klepsparende aortawortelvervanging wordt overwogen, is chirurgie geïndiceerd bij een diameter van 45 mm. Preoperatief moet altijd een MRI-onderzoek
van de gehele aorta worden uitgevoerd om een occulte dissectie
of aneurysma uit te sluiten. Bij patiënten ouder dan 50 jaar moet
preoperatief coronaire angiografie worden verricht.
De klassieke en bekendste chirurgische vervanging van de aortawortel is de bentallprocedure, waarbij aortaklep en aorta ascendens gezamenlijk worden vervangen door een graft met kunstklep. De mortaliteit van een electieve bentallprocedure is < 2%,
van een spoedingreep varieert de mortaliteit van 15 tot 25%. Als
alternatief kan tegenwoordig een klepsparende aortawortelvervanging worden overwogen.
De 5- en 10-jaarsoverleving na een bentallprocedure is respectievelijk 80 en 60%. Deze toch beperkte prognose is het gevolg van
het optreden van verwijdingen en dissecties in de distale aorta.
Ook na de operatie geldt derhalve dat alle marfanpatiënten
levenslang moeten worden behandeld met bètablokkers. Daarnaast moet de gehele aorta regelmatige worden geëvalueerd met
behulp van echografie en MRI en is endocarditisprofylaxe noodzakelijk.
44.16 Zwangerschap, partus en anticonceptie
44.16.1 Inleiding
Figuur 44.24 MR-opname van een aortaboog bij de ziekte van Marfan.
Opmerkelijk is de dilatatie van de aortawortel.
In de westerse wereld zijn aangeboren hartziekten de meest
voorkomende hartziekten tijdens zwangerschap. Zwangerschap
leidt tot een toename van 50% van het moederlijk plasmavolume en van de cardiac output. De systeemvaatweerstand daalt
met ongeveer 20%. Tijdens de partus neemt de cardiac output
nog verder toe en peripartum ontstaan er volumewisselingen en
veranderingen in de systeemvaatweerstand. Deze hemodynamische veranderingen vormen een potentieel risico voor vrouwen
418
met een aangeboren hartafwijking en hun ongeboren kind. Ook
de verhoogde stollingsneiging tijdens de zwangerschap kan een
risico zijn.
44.16.2 Risico’s voor de moeder
De meest voorkomende cardiale complicaties zijn ritmestoornissen en decompensatio cordis. Daarnaast is er een verhoogd
risico op dissectie van de aorta, trombo-embolische complicaties en overlijden. Er zijn ook aanwijzingen voor een frequenter
voorkomen van zwangerschapshypertensie en (pre-)eclampsie.
Obstetrische complicaties (te vroeg breken van de vliezen, voortijdige weeënactiviteit) komen eveneens vaker voor.
Factoren die het risico verhogen zijn onder meer een hogere
NYHA-klasse, cyanose, een voorgeschiedenis van ritmestoornissen, manifeste decompensatio cordis of trombo-embolische
events, een lage ejectiefractie (< 40%) van het systeemventrikel,
een obstructieve linkszijdige hartafwijking, pulmonale hypertensie en een mechanische kunstklep.
In verband met een hoog risico voor de moeder is zwangerschap
gecontra-indiceerd bij NYHA III-IV, ernstige pulmonale hypertensie (intrapulmonale druk hoger of gelijk aan twee derde van
de systeemdruk), het eisenmengersyndroom, ernstige linkszijdige obstructieve afwijkingen (mitralisklepstenose, aortaklepstenose, hypertrofisch obstructieve cardiomyopathie) en ernstige
dilatatie van de aorta bij het syndroom van Marfan.
44.16.3 Risico’s voor het kind
Naast het risico op herhaling van de aangeboren hartafwijking is
er een verhoogd risico op vroege en late abortus, premature
geboorte, intra-uteriene groeiachterstand met een laag geboortegewicht en overlijden. Factoren die voorspellend zijn voor een slechtere uitkomst zijn onder andere een hogere NYHA-klasse, cyanose, linkszijdig obstructief kleplijden, roken en anticoagulantiagebruik tijdens de zwangerschap en een meerlingzwangerschap.
44.16.4 Medicatie en niet-medicamenteuze
therapie tijdens zwangerschap
Gebruik van medicijnen tijdens de zwangerschap kan een negatieve invloed hebben op de ontwikkeling van de foetus. Bij de
indicatiestelling en de dosering van medicatie moet hiermee
rekening worden gehouden, maar de behandelaar dient zich te
realiseren dat hemodynamische problemen bij de moeder een
grotere bedreiging vormen voor het kind dan veel medicamenten. Behandelingen met weinig risico zijn onder andere zout- en
vochtbeperking, digoxine, diuretica, nitroglycerine, hydralazine, bètablokkers, adenosine, kinidine, verapamil, lidocaïne, procaïnamide en lage dosis aspirine.
ACE-remmers en A-II-receptorantagonisten zijn gedurende de
gehele zwangerschap absoluut gecontra-indiceerd. Ook amiodaron is ongewenst. Statines moeten al vóór de conceptie worden
gestaakt.
DEEL G CONGENITALE HARTAFWIJKINGEN, PERICARDZIEKTEN EN TUMOREN
Van elektrocardioversie zijn geen negatieve effecten voor de
foetus beschreven, ook elektrische shocks van een ICD geven
geen problemen.
Gebruik van cumarinederivaten in het eerste trimester leidt tot
een hoog risico op spontane abortus (30%) en (dosisafhankelijk)
teratogene afwijkingen (5-7%) zoals hypoplasie van de neus en
andere botafwijkingen. Bij gebruik na het eerste trimester kunnen in zeer zeldzame gevallen neurologische afwijkingen voorkomen. Bij ontstolling met een cumarinederivaat is een vaginale partus gecontra-indiceerd in verband met het risico op intracerebrale bloedingen bij het kind. Wordt een vaginale partus
nagestreefd, dan moet de moeder rond de 36e week worden
overgezet op (laagmoleculairgewicht)heparine. Het in Nederland meest gebruikte antistollingsregime tijdens de zwangerschap houdt in dat zodra de zwangerschap zich manifesteert,
wordt overgegaan op een volledige dosering laagmoleculairgewichtheparine. In het tweede en derde trimester kan tot de 36e
week weer het cumarinederivaat worden gebruikt. Bij hoogrisicopatiënten (klepprothese) wordt wel geadviseerd antifactorXa-spiegels te monitoren en een lage dosis aspirine bij te geven.
Tijdens de zwangerschap leiden klepprothesen bij ieder antistollingsregime tot een hoger risico op kleptrombose dan buiten
de zwangerschap. Hierbij zijn de mortaliteit en de morbiditeit
(embolieën) hoog.
44.16.5 Begeleiding voor, tijdens en na
zwangerschap
Uiteraard moet de vrouw met een aangeboren hartafwijking (en
haar partner) tijdig, al voor de conceptie, advies krijgen over de
risico’s van zwangerschap voor haarzelf en haar kind. Vooral bij
vrouwen met een contra-indicatie voor zwangerschap is het
zaak tijdig alert te zijn op het geven van goede voorlichting. Tijdens de zwangerschap zijn de intensiteit en de aard van de cardiologische controles afhankelijk van de aard en de ernst van de
onderliggende afwijking en van de NYHA-klasse. Vaak kan met
enkele controles (gecombineerd met echografie en eventueel ritmecontrole) worden volstaan. Daarnaast moeten gynaecologische controles plaatsvinden met extra aandacht voor de groei en
ontwikkeling van de foetus. Ook wordt in veel gevallen rond de
18e-20e week een echo-onderzoek verricht gericht op de aanwezigheid van structurele hartafwijkingen bij de foetus. Bij
vrouwen met NYHA I zijn meestal geen speciale maatregelen
nodig, afgezien van eventuele endocarditisprofylaxe. Een uitzondering is ernstige aortadilatatie bij het syndroom van Marfan, waarbij de stress van de bevalling moet worden gereduceerd
in verband met het risico op aortadissectie. Maatregelen die de
cardiale belasting van de bevalling verminderen (linkerzijligging, epidurale anesthesie, primair vacuümextractie/forceps)
moeten ook worden overwogen bij patiënten met NYHA-klasse
≥ II en bij patiënten met een gefixeerde cardiac output (aortastenose). Soms is hemodynamische bewaking zinvol. Een sectio
caesarea kan doorgaans worden beperkt tot obstetrische indicaties.
Na de bevalling ontstaat een fysiologische overvulling, die bij
geselecteerde patiënten reden kan zijn tot enige dagen extra
44
419
CONGENITALE HARTZIEKTEN
observatie. Hoewel endocarditisprofylaxe officieel alleen geïndiceerd is bij een gecompliceerde bevalling, wordt deze profylaxe om praktische redenen vaak direct vóór de bevalling gegeven.
44.16.6 Anticonceptie
Veel vrouwen met aangeboren hartafwijkingen hebben gedurende (een deel van) hun reproductieve leven behoefte aan een
vorm van anticonceptie. Vaak zijn laaggedoseerde orale anticonceptiva de beste keuze. Een uitzondering vormen vrouwen
met een verhoogde tromboseneiging (bijvoorbeeld cyanotische
vrouwen en vrouwen met een fontancirculatie), dan is de hormoonspiraal (mirenaspiraal) een goed alternatief. Andere mogelijkheden zijn progestativa (minipil, depotpreparaat), maar deze
kunnen tot vochtretentie leiden. Barrièremethoden met een
zaaddodend middel zijn ook mogelijk.
•
•
•
Kernpunten
• Veruit de meeste aangeboren hartafwijkingen zijn multifactorieel bepaald. Bij multifactoriële afwijkingen is er bij
alle eerstegraads familieleden een verhoogde prevalentie
van aangeboren hartafwijkingen.
• Nakomelingen van vrouwen met een aangeboren hartafwijking hebben vaker een dergelijke afwijking dan nakomelingen van mannen met een aangeboren hartafwijking.
• Voorlichting door een klinisch-geneticus is geïndiceerd
bij vragen over erfelijkheid of bij een positieve familieanamnese.
• Een sinus-venosus-defect kan bij dopplerechocardiografie
makkelijk gemist worden. Bij onbegrepen dilatatie van de
rechter harthelft moet het bovenste gedeelte van het septum nauwkeurig worden bekeken op de subcostale of
suprasternale opname, eventueel met behulp van transoesofageale echocardiografie.
• Sluiten van een atriumseptumdefect is geïndiceerd bij
alle patiënten met tekenen van rechterventrikeloverbelasting na de leeftijd van 3 jaar. Sluiten van een persisterend foramen ovale is geïndiceerd bij patiënten met recidiverende transient ischaemic attacks en een persisterend
foramen ovale.
• Een groot geïsoleerd ventrikelseptumdefect leidt nooit
tot decompensatie in de eerste levensdagen, wel na enkele weken.
• De shunt door een klein ventrikelseptumdefect maakt een
luid, hoogfrequent geruis: veel geruis = gunstig. De shunt
door een groot ventrikelseptumdefect is zwak, ruw en
laagfrequent: weinig geruis = ongunstig.
• Sluiten van een ventrikelseptumdefect is geïndiceerd in
de volgende situaties:
– te verwachten en/of aanhoudende decompensatie bij
de zuigeling;
•
•
•
•
•
•
•
– shunt > 1,5/1 na de leeftijd van 3 jaar met ventrikelvolumeoverbelasting;
– na een doorgemaakte endocarditis;
– subarterieel ventrikelseptumdefect;
– subaortaal ventrikelseptumdefect met een prolaps van
een van de klepbladen van de aortaklep;
– optreden van subvalvulaire aortastenose, ‘double chambered right ventricle’;
– ontwikkeling van pulmonale hypertensie.
Ook na sluiting van een ventrikelseptumdefect kunnen
late complicaties optreden, zoals verminderde linkerventrikelfunctie of pulmonale hypertensie.
Patiënten met een geopereerd compleet atrioventriculair
septumdefect moeten levenslang gecontroleerd worden in
verband met frequente cardiale restafwijkingen na operatie.
Door de bijkomende afwijkingen van de linker atrioventriculaire klep en van het geleidingssysteem is het natuurlijke beloop van een incompleet atrioventriculair septumdefect gunstiger dan dat van een compleet atrioventriculair
septumdefect, maar in het algemeen slechter dan het
natuurlijke beloop van een ander type atriumseptumdefect.
Vooral met het oog op het cumulatieve risico op endarteriitis wordt ook een kleine persisterende ductus arteriosus
in principe gesloten, behalve de ‘stille’ miniductus.
Het belangrijkste bij de behandeling van patiënten met
het eisenmengersyndroom is het vermijden van factoren
die het wankele hemodynamische evenwicht kunnen verstoren. Controle van patiënten met dit syndroom moet
plaatsvinden in centra die zijn gespecialiseerd in aangeboren hartafwijkingen bij volwassenen.
Flebotomie is alleen geïndiceerd bij patiënten met het
eisenmengersyndroom die zowel duidelijke klachten van
hyperviscositeit hebben als een hematocriet > 65%.
Bij patiënten met het eisenmengersyndroom vormt zwangerschap een zeer hoog risico.
Tegenwoordig worden nieuwe vormen van medicamenteuze therapie geprobeerd bij patiënten met het eisenmengersyndroom.
Een coarctatio aortae moet worden behandeld met een
operatie of ballondilatatie; een onbehandelde coarctatie
heeft een slechte prognose. Na operatie of dilatatie is
levenslange follow-up vereist. Kernpunten van deze follow-up zijn:
– detectie en behandeling van recoarctatie of resthypoplasie van de aortaboog;
– detectie en behandeling van hypertensie;
– bestrijding van risicofactoren voor atherosclerose;
– opsporen van aneurysmavorming (operatiegebied en
aorta ascendens);
– follow-up van bijkomende afwijkingen (onder andere
bicuspide aortaklep).
Een geringe pulmonalisklepstenose (gradiënt < 50 mmHg)
is weinig progressief en hoeft slechts incidenteel te wor-
420
•
•
•
•
•
•
•
•
•
•
•
•
•
DEEL G CONGENITALE HARTAFWIJKINGEN, PERICARDZIEKTEN EN TUMOREN
den vervolgd. Een ernstige pulmonalisklepstenose (gradiënt > 80 mmHg) moet altijd worden behandeld, bij
voorkeur met ballondilatatie.
Bij patiënten met een pulmonalisklepstenose is levenslange endocarditisprofylaxe geïndiceerd.
Ernstige pulmonalisklepinsufficiëntie kan het gevolg zijn
van de behandeling en is op lange termijn vaak een indicatie voor klepvervanging.
Vrijwel alle volwassen patiënten met een tetralogie van
Fallot hebben restafwijkingen, waarvan pulmonalisklepinsufficiëntie het meest voorkomt. Daarom hebben alle
patiënten met een tetralogie van Fallot levenslange,
regelmatige cardiologische follow-up nodig en is reïnterventie frequent noodzakelijk.
Een pulmonalisklepinsufficiëntie is het onvermijdelijke
gevolg van verwijding van de pulmonalisanulus bij een
operatie in verband met een tetralogie van Fallot. Bij
patiënten met een ernstige pulmonalisklepinsufficiëntie
en ernstige rechterventrikeldilatatie is vervanging van de
pulmonalisklep geïndiceerd.
Bij patiënten met een tetralogie van Fallot en een QRSduur > 180 ms is het risico op ventriculaire ritmestoornissen en acute hartdood sterk verhoogd.
Bij patiënten met slechts één functioneel ventrikel is een
fontanoperatie de meest gangbare chirurgische behandeling.
Patiënten met een fontancirculatie moeten worden
gecontroleerd in een centrum dat gespecialiseerd is in
aangeboren hartafwijkingen bij volwassenen.
Omdat er na een fontanoperatie geenszins een normale
anatomie of circulatie is gecreëerd en omdat de morbiditeit en de mortaliteit na de operatie aanzienlijk zijn,
spreekt men niet van een chirurgische correctie maar van
definitieve palliatie.
Om het risico op trombo-embolieën bij fontanpatiënten
te verlagen worden vaak orale anticoagulantia voorgeschreven. Het is onduidelijk of deze behandeling effectief
is.
Bij moeilijk behandelbare ritmestoornissen moet worden
overwogen een ‘modernere’ fontanconstructie uit te voeren in combinatie met ritmechirurgie.
Bij een transpositie van de grote vaten heeft de huidige
techniek van arteriële switch een laag risico met goede
resultaten op middellange termijn. Van de nu volwassen
patiëntenpopulatie heeft de overgrote meerderheid op de
kinderleeftijd een veneuze ompolingsoperatie ondergaan.
Bij een transpositie van de grote vaten is na een veneuze ompolingsoperatie volgens Mustard of Senning het
rechter ventrikel systeemventrikel.
Bij patiënten met een transpositie van de grote vaten
komt vanaf jongvolwassen leeftijd in toenemende mate
hartfalen ten gevolge van rechterventrikelfalen voor.
• Atriale ritmestoornissen komen frequent voor na een
veneuze ompolingsoperatie, meestal sinusknoopdisfunctie en macro-re-entrytachycardieën rond littekens in de
atria.
• Een ‘baffle’-stenose komt vaker voor na de veneuze ompolingsoperatie volgens Mustard dan na de senningoperatie.
De stenose kan worden behandeld met stentimplantatie.
• Patiënten met een congenitaal gecorrigeerde transpositie
van de grote vaten zonder bijkomende intracardiale afwijkingen worden vaak pas op volwassen leeftijd symptomatisch. Met het ouder worden neemt het percentage
patiënten bij wie een compleet atrioventriculair blok is
opgetreden met ongeveer 2% per jaar toe. Vanaf jongvolwassen leeftijd neemt het aantal patiënten met rechterventrikelfalen geleidelijk toe. Op de leeftijd van 50 jaar
heeft slechts 10% van de patiënten géén hartfalen.
• Controle van volwassenen met de ziekte van Ebstein moet
plaatsvinden in centra die zijn gespecialiseerd in aangeboren hartafwijkingen bij volwassenen.
• Bij de ziekte van Ebstein kan de beperking van het
inspanningsvermogen het gevolg zijn van ernstige tricuspidalisklepinsufficiëntie, ritmestoornissen of een te klein
linker ventrikel door septumverplaatsing.
• De diagnose syndroom van Marfan wordt momenteel nog
gesteld op grond van klinische verschijnselen en familieanamnese. De diagnose wordt gesteld door een multidisciplinair team. DNA-analyse maakt steeds vaker een
moleculaire bevestiging mogelijk.
• MRI- of CT-onderzoek van de gehele aorta is bij iedere
patiënt met het syndroom van Marfan geïndiceerd omdat
20% van de aortadissecties optreedt in de abdominale
aorta.
• Ook na de operatie geldt derhalve dat alle marfanpatiënten levenslang moeten worden behandeld met bètablokkers. Daarnaast moet de gehele aorta regelmatige worden
geëvalueerd met behulp van echografie en MRI en is
endocarditisprofylaxe noodzakelijk.
• Zwangerschap is gecontra-indiceerd bij NYHA III-IV, ernstige pulmonale hypertensie, het eisenmengersyndroom,
ernstige linkszijdige obstructieve afwijkingen en ernstige
aortaworteldilatatie bij het syndroom van Marfan.
• Het risico voor moeder en kind is onder andere afhankelijk van de NYHA-klasse, cyanose, de functie van het systeemventrikel en linkszijdig obstructief kleplijden.
• Hoewel sommige medicijnen absoluut gecontra-indiceerd
zijn tijdens zwangerschap, geldt vaak dat het risico van
hemodynamische problemen bij de moeder bedreigender
is voor het kind dan veel cardiale medicamenten.
• Bij vrouwen met een aangeboren hartafwijking heeft een
vaginale partus doorgaans de voorkeur boven een sectio
caesarea.
44
CONGENITALE HARTZIEKTEN
421
Literatuur
Bosch AE van den, Roos-Hesselink JW, Domburg R van, Bogers AJJC, Simoons ML, Meijboom FJ. Long-term outcome and
quality of life in adult patients after the Fontan operation. Am J Cardiol. 2004;93:1141-5.
Drenthen W, Pieper PG, Tuuk K van der, Roos-Hesselink JW, Voors AA, Mostert B, et al. (Zahara study). Cardiac complications
relating to pregnancy and recurrence of disease in the offspring of women with atrioventricular septal defects. Eur Heart J.
2005;26:2581-7.
Gatzoulis MA, Balaji S, Webber SA, Siu SC, Hokanson JS, Poile C, et al. Risk factors for arrhythmia and sudden death late after
repair of tetralogy of Fallot: a multi-centre study. Lancet. 2000;356:975-81.
Gatzoulis MA, Webb G, Daubeney P, editors. Diagnosis and management of adult congenital heart disease. New York: Elsevier;
2003.
Gewillig M. The Fontan circulation. Heart. 2005;91:839-6.
Graham TP, Bernard YD, Mellen BG, Celermajer D, Baumgartner H, Cetta F, et al. Long-term outcome in congenitally corrected
transposition of the great arteries: a multi-institutional study. J Am Coll Cardiol. 2000;36:255-61.
Meijboom LF, Vos FE, Timmermans J, Boers GH, Zwinderman AH, Mulder BJ. Pregnancy and aortic root growth in the Marfan
syndrome, a prospective study. Eur Heart J. 2005;26:914-20.
Mulder BJM, Pieper PG, Meijboom FJ, Hamer JPM, redacteuren. Aangeboren hartafwijkingen bij volwassenen. Houten:
Bohn Stafleu van Loghum; 2006.
Nollen GJ, Mulder BJ. What is new in the Marfan syndrome? Int J Cardiol. 2004;97 Suppl I:103-8.
Oakley C, Warner C, editors. Heart disease in pregnancy. Oxford: Blackwell; 2007.
Paepe A de, Devereux RB, Dietz HC, Hennekam RC, Pyeritz RE. Revised diagnostic criteria for the Marfan syndrome.
Am J Med Genet. 1996;62:417-26.
Roos-Hesselink JW, Meijboom FJ, Spitaels SEC, Domburg R van, Rijen EHM van, Utens EMWJ, et al. Decline in ventricular
function and clinical condition after mustard repair for transposition of the great arteries (a prospective study of 22-29 years).
Eur Heart J. 2004;25:1264-70.
Velde ET van der, Vriend JW, Mannens MM, Uiterwaal CS, Brand R, Mulder BJM. CONCOR, an initiative towards a national
registry and DNA-bank of patients with congenital heart disease in the Netherlands: rationale, design, and first results.
Eur J Epidemiol. 2005;20:549-57.
Wall EE van der, Mulder BJM. Pulmonary valve replacement in patients with tetralogy of Fallot and pulmonary regurgitation:
early surgery similar to optimal timing of surgery? Eur Heart J. 2005;26:2614-15.
Working Group Congenital Cardiology in Adults of the Netherlands Society of Cardiology. Adult congenital heart disease in the
Netherlands. Guidelines 2000. Den Haag: Nederlandse Hartstichting; 2000.