1
VII.Metalen
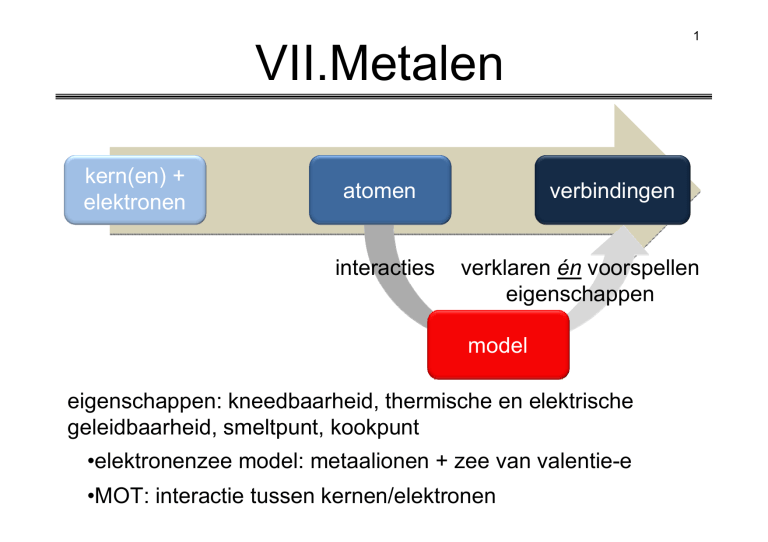
kern(en) +
elektronen
atomen
interacties
verbindingen
verklaren én voorspellen
eigenschappen
model
eigenschappen: kneedbaarheid, thermische en elektrische
geleidbaarheid, smeltpunt, kookpunt
•elektronenzee model: metaalionen + zee van valentie-e
•MOT: interactie tussen kernen/elektronen
•structuur van metalen
•bolstapeling: regelmatige stapeling van metaalatomen
•eenheidscellen: pc, bcc, fcc, (hcp)
•binding in metalen: elektronen zijn gedelokaliseerd
•elektronenzeemodel: kationen in zee van valentie-el.
•MOT of bandtheorie: combinatie van AO ⇒ band van MO
•bandvorming: s-band, sp-band; sd-band
•valentieband, conductieband en bandkloof
•geleiders, halfgeleiders, isolatoren
•definitie
•doperen van halfgeleiders (n-type; p-type)
•supergeleiders
•legeringen (zelfstudie)
2
3
Structuur van metalen
Kristalroosters
4
Primitief kubische bolstapeling
coördinatiegetal = aantal dichtste naburen
6 dichtste naburen
eenheidscel:
primitief kubisch
1
8
AAAAAA
1
⎛ atomen ⎞
⎜
⎟ = ×8 =1
⎝ eenheidscel ⎠pc 8
5
Ruimtelijk gecentreerd kubische
bolstapeling
bcc (body centered cubic)
eenheidscel:
ruimtelijk gecentreerd
kubisch
1
8
8 dichtste naburen
1
1
⎛ atomen ⎞
=
1
+
×8 = 2
⎜
⎟
8
⎝ eenheidscel ⎠bcc
6
7
Dichtste bolstapelingen
trigonale holte
8
hexagonaal dichtste stapeling
kubisch dichtste stapeling
ABCABC
ABABAB
fcc
hcp
12 dichtste naburen
Kubisch dichtste bolstapeling
9
10
Vlakgecentreerd kubische stapeling
fcc (face centered cubic)
12 dichtste naburen
1
8
1
2
⎞
⎛1
⎞ ⎛1
⎛ atomen ⎞
6
8
+
×
=
×
⎟=4
⎜
⎟ ⎜
⎜
⎟
⎠
⎠ ⎝8
⎝ eenheidsce l ⎠ fcc ⎝ 2
11
Hexagonaal dichtst gepakte stapeling
hcp (hexagonal close packed)
12 dichtste naburen
⎛1
⎞ ⎛1 ⎞
⎛ atomen ⎞
=
3
+
×
12
⎜
⎟
⎜
⎟ + ⎜ × 2⎟ = 6
⎝6
⎠ ⎝2
⎠
⎝ eenheidscel ⎠bcc
niet te kennen
12
Metaalrooster bevat holten of interstiële ruimten
Kubische eenheidscellen
primitief kubisch
1
8
ruimtelijk
gecentreerd kubisch
vlakgecentreerd
kubisch
1
8
1
8
1
1
⎛ atomen ⎞
⎜
⎟ = ×8 =1
⎝ eenheidscel ⎠pc 8
13
1
⎛ atomen ⎞
= 1+ × 8 = 2
⎜
⎟
8
⎝ eenheidscel ⎠bcc
1
2
⎛ atomen ⎞
⎛1
⎞ ⎛1
⎞
⎜
⎟ = ⎜ × 6⎟ + ⎜ × 8⎟ = 4
⎝ eenheidsce l ⎠ fcc ⎝ 2
⎠ ⎝8
⎠
14
stapeling
patroon
CG
PF
eenheidscel
kubisch
AAAAAA
6
0.52
pc
ruimtelijk
gecentreerd kubisch
ABABAB
8
0.68
bcc
hexagonaal dichtst
gepakt
ABABAB
12
0.74
hcp
kubisch dichtst
gepakt
ABCABC
12
0.74
fcc
⎛4 3⎞
⎛ atomen ⎞
⎟ × ⎜ πr ⎟
⎜
Vatomen ⎝ ec ⎠ec ⎝ 3
⎠
PFec =
=
Vec
Vec
PF: pakkingsfactor
CG: coördinatiegetal
ec: eenheidscel
r: atoomstraal
15
Binding in metalen
Elektronen zijn gedelokaliseerd
Na: valentieconfiguratie = 3s1
8 naburen
valentie-elektronen zijn
gedelokaliseerd over kristal
bcc-rooster
(body centered cubic)
16
17
Modellen voor beschrijving binding
in metalen
•elektronenzeemodel
•verklaring elektrische & thermische geleidbaarheid metalen
•verklaring mechanische eigenschappen metalen
•verklaring smeltpunt metalen NIET mogelijk
•MOT of bandmodel
•verklaring smeltpunt metalen
•verklaring geleider/half-geleider/isolator
18
Elektronenzeemodel
19
−
−
−
−
−
−
−
−
3D schikking
−
−
−
−
−
−
−
elektrostatische krachten
valentie-el. vrij beweeglijk over het volledige metaalkristal
sterkte binding ↑ met toenemend aantal valentie-el.
Verklaring geleidbaarheid
•elektrische geleidbaarheid
vrij beweeglijke valentie-elektronen
⇒ bewegen van − naar +
•thermische geleidbaarheid
vrij beweeglijke valentie-elektronen
⇒ overdracht Ekin van warm → koud
20
Verklaring mechanische
eigenschappen
21
22
Verklaring smeltpunt NIET mogelijk
sterkte binding ↑ met toenemend aantal valentie-e
⇒ model voorspelt toename smeltpunt van Sc → Zn
2000
1800
Smeltpunt (°C)
1600
1400
1200
1000
800
600
400
200
0
Sc
Ti
V
Cr Mn Fe Co
Ni
Cu Zn
23
MOT of Bandmodel
Bandvorming
24
s band: ontstaat door combinatie van groot aantal s AO
Voorbeeld: N Na atomen; N × 3s1 valentie-elektronen
•combinatie van N 3s A.O ⇒ vorming van s band met N M.O
•N 3s1 valentie-elektronen bezetten 1/2 N M.O
25
Energie
conductie- onbezette MO
band
Ferminiveau
HOMO
(Highest Occupied Molecular Orbital)
valentie- bezette MO
band
E laagst gelegen onbezette MO’s verschilt weinig van EFerminiveau
⇒ e kunnen makkelijk geëxciteerd worden naar conductieband
⇒ thermische & elektrische geleidbaarheid
band = aaneengesloten reeks van groot aantal MO’s
Verklaring smeltpunt alkalimetalen
26
200
180
Smeltpunt (°C)
160
140
120
100
80
60
40
20
0
Li
Na
K
Rb
Cs
•slechts 1 valentie-e/atoom
⇒ Li → Cs: zelfde aantal e in bindende MO
•Li → Cs: straal atoom ↑
⇒ Li → Cs: grootte combinerende sAO ↑ ⇒ grootte MO ↑
⇒ Li → Cs: aantrekking door kernen van gedelokaliseerde val.-e ↓
27
p band: ontstaat door combinatie van groot aantal p AO
Es << Ep
sp band: ontstaat door overlap van s en p band
Es ≈ Ep
28
Energie
Mg: 3s2; ΔE 3s en 3p is klein ⇒ vorming sp-band
conductieband
MO*
n Mg-atomen:
2n valentie-elektronen
⇒Mg: geleider
MO
valentieband
smeltpunt: 648°C
29
sd-band: gevormd bij transitiemetalen
overlap d en s-band: sd-band kan 12 valentie-e/atoom bevatten
anti-bindende MO’s kunnen 6 valentie-e/atoom bevatten
Energie
conductieband
conductieband
MO*
MO*
valentieband
valentieband
MO
MO
n Cr (3d5 4s1)
n Fe (3d6 4s2)
6n valentie-elektronen
8n valentie-elektronen
⇒ enkel bindende MO’s bezet
smeltpunt: 1860°C
⇒ ook anti-bindende MO’s bezet
smeltpunt: 1535°C
bindende MO’s kunnen 6 valentie-e/atoom bevatten
30
Geleiders, halfgeleiders
en isolatoren
31
conductieband
geleidbaarheid↓ als T↑
valentieband
T=0K
T>0K
isolator
halfgeleider
conductieband
Energie
conductieband
Energie
Energie
geleider
bandkloof
bandkloof
valentieband
valentieband
T=0K
T>0K
T=0K
T>0K
geleidbaarheid↑ als T↑
32
conductivity: elektrische geleidbaarheid [S/m; S: Siemens]
silicon: silicium (Si); halfgeleider
tungsten: wolfraam (W); geleider
Doperen van half-geleiders
•n type half-geleiders
doperen Si met groep VA element; bvb. P
Si: 3s2 3p2
zuiver Si-kristal
valentieband conductieband
valentieband
conductieband
P: 3s2 3p3
P-gedopeerd Si-kristal
33
34
•p type half-geleiders
doperen Si met groep IIIA element; bvb. Ga
Si: 3s2 3p2
zuiver Si-kristal
Ga-gedopeerd Si-kristal
valentieband conductieband
valentieband
conductieband
Ga: 4s2 4p1
Supergeleiders
•materiaal dat weerstand tegen
elektrische geleiding verliest
beneden kritische temperatuur Tc
•Tc is karakteristiek voor het
materiaal
Voorbeeld: Tc voor Hg = 4.2K
voor T < 4.2K: Hg is een perfecte geleider
⇒ geen energieverlies door opwarming
35
36
Legeringen
Legeringen
37
•homogene legeringen of oplossingslegeringen:
componenten zijn uniform verdeeld
•substitutionele legering: toegevoegde element bezet roosterposities
•interstitiële legering: toegevoegde element bezet interstitiële holte
•heterogene legeringen:
componenten zijn niet uniform verdeeld
•bevat verschillende fasen
•intermetaalverbinding:
heeft specifieke samenstelling
Homogene legeringen of oplossingslegeringen
substitutionele legering
interstitiële legering
geleidbaarheid ↓
geleidbaarheid ↓
hardheid ↑
hardheid ↑
38
Heterogene legeringen
bevat ≠ fasen
perliet
ferriet: Fe
cementiet: Fe3C (ijzercarbide)
eigenschappen = f(samenstelling, afkoelingsprocedure smelt)
39
Intermetaalverbinding
specifieke samenstelling
40
41
belangrijke vaardigheden
•eigenschappen eenheidscellen
•verklaren eigenschappen metalen met elektronenzee model en MOT
•verklaren smeltpunt metalen met MOT
•n-type en p-type halfgeleiders herkennen
•eigenschappen legeringen
42
43
Roestvast staal (RVS)
Ferritisch RVS (Fe-Cr-legeringen)
Dit zijn roestvast staalsoorten die chroom als enige
hoofdlegeringselement bevatten. Het zijn chroomstalen met
een maximum koolstofgehalte van 0,1%. Door dat lage
gehalte aan koolstof zijn die chroomstalen niet hardbaar. De
ferritische roestvast staalsoorten bevatten 11% tot 17%
chroom zonder nikkel. De meest gekende kwaliteit van de
ferritische roestvast staalsoorten is de ASTM 430. Die bevat
ongeveer 17% chroom. Deze kwaliteit wordt vooral gebruikt
voor goedkopere huishoudelijke toepassingen en
bekledingen.
44
Austenitisch RVS (Fe-Cr-Ni-legeringen)
Dit is de voornaamste groep van de roestvast staalsoorten.
Deze groep bevat als hoofdlegeringselement naast chroom ook
nikkel. Nikkel verbetert de corrosiebestendigheid. Het meest
klassieke chroom-nikkelstaal is AISI 304 (18/8) met 18%
chroom en 8% nikkel. De tweede meest gebruikte kwaliteit is
AISI 316 (18/10/2,5) met 18% chroom, 10% nikkel en 2,5%
molybdeen. Deze roestvast staalsoort heeft als eigenschap een
verhoogde corrosiebestendigheid tegen verschillende zuren, en
doet het ook goed in de nabijheid van de zee (chloriden enz.).
Zij vormen de groep van klassieke (goed lasbare) roestvast
staalsoorten voor aanwending in chemische installaties, in de
voedings-, de papier-, farmaceutische- en de
automobielindustrie. De AISI 304 en de AISI 316
vertegenwoordigen ongeveer 65% van de
wereldstaalproductie.










