Alzheimer: hoop gevestigd op middelen tegen amyloïd
advertisement

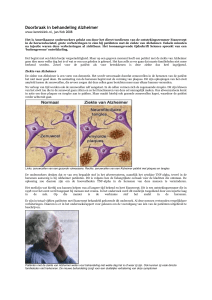
Alzheimer: hoop gevestigd op middelen tegen amyloïd-bèta Explosie aan onderzoeken vergroot kans op ontdekking van een middel PW6 - 10-02-2017 | door Cindy Reinders Er zit schot in de strijd tegen de ziekte van Alzheimer. Deze zomer komen de eerste fase IIIonderzoeksresultaten van de BACE-remmer verubecestat naar buiten en in 2021 die van het monoklonaal antilichaam aducanumab. Vergeleken met eerder onderzochte middelen zouden deze het ziekteproces echt kunnen vertragen. “De vraag is niet meer óf we een geneesmiddel gaan vinden voor de ziekte van Alzheimer, maar wanneer.” Daar is neuroloog Niels Prins echt van overtuigd, ook al blijken alle studies tot nu toe negatief. Als directeur van het Alzheimer Research Center (ARC) in Amsterdam en neuroloog bij het VUmc Alzheimercentrum heeft hij een goed beeld van het aantal onderzoeken dat loopt. “Het zijn er gigantisch veel en het aantal stijgt explosief. Daardoor neemt de kans dat er echt een ziektemodificerend geneesmiddel gevonden zal worden enorm toe.” Enorme markt Op dit moment lijden ruim 270.000 mensen in Nederland aan een vorm van dementie, van wie ongeveer 70% de ziekte van Alzheimer heeft. Naar verwachting zal dit aantal in 2040 verdubbeld zijn [1,2]. “Een enorme markt dus, mocht een middel worden gevonden”, zegt Prins. “Daarom heeft bijna elk groot farmabedrijf wel onderzoek lopen naar een geneesmiddel voor alzheimer. En ze hopen allemaal als eerste een werkzaam middel te vinden.” Maar dat ‘first-to-market willen zijn’ is overigens ook een van de redenen waarom zoveel fase III-studies mislukken, denkt Prins. “Fabrikanten blijven soms te lang hoop hebben. Zo had solanezumab bijvoorbeeld, dat onlangs niet werkzaam bleek, nooit moeten doorgaan naar fase III.” Andere verklaringen voor terugkerende negatieve resultaten zijn volgens hem: een verkeerd target zoals bij solanezumab, een te lage dosis of een onjuiste patiëntenpopulatie. Mensen blijken toch geen alzheimer te hebben (zoals in de studie met bapineuzumab) of de ziekte is al te ver gevorderd, waardoor een mogelijk effect moeilijk aantoonbaar is. Beginstadium Een trend van de laatste jaren is dan ook dat het onderzoek zich steeds meer richt op het allereerste stadium van de ziekte, vertelt Prins. “Tegenwoordig zoeken we ook mensen ouder dan 60 jaar die geen klachten hebben (zie kader), maar wel een risico hebben op het krijgen van alzheimer.” Daarvan is sprake als de hoeveelheid van het eiwit amyloïd-bèta in het hersenvocht verlaagd is (te bepalen via een ruggenprik of met een PET-scan), doordat het eiwit in de hersenen is neergeslagen – amyloïdplaques. Prins gelooft nog steeds dat de amyloïdhypothese de belangrijkste pathofysiologische theorie is voor het ontstaan van alzheimer. Veel geneesmiddelen die momenteel onderzocht worden, zijn op een of andere manier gericht op amyloïd-bèta. Geneesmiddelen die de vorming ervan remmen via het enzym bèta-secretase, worden BACEremmers genoemd. Verubecestat, dat nu in fase III verkeert, is daarvan een voorbeeld. Het zou een eerste kandidaat kunnen zijn, zegt Prins, als de resultaten in fase III net zo veelbelovend zijn als in fase I [3]. “Daarin zagen we een reductie van ongeveer 80% van amyloïd-bèta in het hersenvocht.” Komende zomer verwacht hij de resultaten van de eerste fase III-studie, waarin dit middel is getest bij patiënten met een milde tot ernstige vorm van de ziekte van Alzheimer. De resultaten van de fase III-studie, die onderzoekt of verubecestat effect heeft in een voorstadium (milde cognitieve stoornissen) van de ziekte van Alzheimer, volgen in 2019. Amyloïd-bèta kan ook worden opgeruimd via actieve en passieve immunisatie. Binnenkort start bij het ARC een studie waarin het effect van een BACE-remmer wordt vergeleken met een actief vaccin (CAD106). De deelnemers uit de immunisatiegroep krijgen dan een stukje amyloïd-bèta ingespoten, waardoor de productie van antilichamen wordt gestart. Wanneer die vervolgens binden aan amyloïd-bèta, kunnen de afweercellen van de hersenen (microglia) de eiwitten opruimen. Een nadeel van actieve immunisatie, vindt Prins, is dat je geen controle hebt op de productie van de antistoffen. “Is de aanmaak daarvan eenmaal geïnitieerd, dan valt die niet meer te stoppen.” Aducanumab Goede hoop heeft de onderzoeksdirecteur op het monoklonale antilichaam aducanumab. Dit mabje is – in tegenstelling tot solane-zumab – ook gericht tegen de schadelijke oligomeren in amyloïd-bèta. “Solanezumab bond alleen de oplosbare monomeren die niet toxisch lijken te zijn.” Sevigny et al. publiceerden afgelopen augustus de veelbelovende resultaten van de fase Ib (PRIME)-studie met aducanumab in Nature [4]. Prins: “Zo’n enorme afname van het amyloïdeiwit met daarbij een stabiele hersenfunctie, heb ik nog niet eerder gezien. Het is nu alleen afwachten of dit effect ook in de fase III (EMERGE)-studie wordt bevestigd en of de bijwerkingen acceptabel zijn.” Aan de PRIME-studie deden 165 patiënten met een voorstadium of lichte vorm van alzheimer mee. Zij hadden vooral last van anti-amyloïdgerelateerde bijwerkingen (ARIA; amyloid related imaging abnormalities), zowel vochtophoping in de hersenen (type E) als microbloedingen (type H). Deze bloedingen kunnen ontstaan wanneer het amyloïdeiwit ook in de bloedvaten wordt opgeruimd en de poreuze vaatwand gaat lekken, legt Prins uit. Gantenerumab is een ander monoklonaal antilichaam dat in fase III wordt onderzocht [5]. Dit middel is net als aducanumab ook gericht tegen het schadelijke deel van het amyloïd-bèta. Belangrijk target Dit eiwit is echter niet als enige betrokken bij de pathogenese van de ziekte van Alzheimer. Ook het eiwit tau vormt aggregaten wanneer te veel van dit eiwit is gekoppeld met fosfaten. Tau is daarom ook een belangrijk target voor nieuwe geneesmiddelen. Afgelopen zomer sneuvelde overigens weer een kanshebber. Een bepaalde vorm van methyleenblauw (TRx 0237) gericht tegen het samenklonteren van tau, bleek in fase III niet effectief bij de ziekte van Alzheimer [6], en ook niet bij frontotemporale dementie. Verder verkeert een monoklonaal antilichaam (C2N 8E12) tegen het tau-eiwit – waarvoor geen opname van het antilichaam in neuronen vereist is – nu in fase II-onderzoek. De studie is onlangs gestart onder vierhonderd patiënten met een beginstadium van alzheimer en eindigt in 2020 [7]. Een andere fase II-studie onderzoekt momenteel de effectiviteit en veiligheid van een actief vaccin tegen tau (AADvac1). Novak et al. publiceerden onlangs de resultaten van fase I waarin 29 van de dertig patiënten met alzheimer een IgG-immuunrespons vertoonden [8]. Zwak bewijs Weer een ander werkingsmechanisme heeft VX-745 (USAN-name: neflamapimod, in afwachting van een international nonproprietary name [INN]), waarmee onlangs twee fase IIa-studies zijn afgerond. Dit middel remt het enzym MAP-kinase en heeft daarmee een neuroprotectief effect. VX-745 stimuleert ook de opruiming van amyloïd-bèta door de microglia [9]. Studies naar het effect van bekende geneesmiddelen bij alzheimer, zoals duloxetine, carvedilol en simvastatine, lopen niet bij het ARC. Prins heeft hiervan dan ook geen hoge verwachtingen. “Het zou natuurlijk ideaal zijn als deze middelen uitbereiding van indicatie zouden krijgen voor de ziekte van Alzheimer, maar het bewijs voor een mechanisme is zwak.” Nodig: proefpersonen zonder klachten “Bent u tussen de 60 en 80 jaar oud en maakt u zich zorgen over geheugenverlies in de toekomst?” Zo begint een advertentie van een onderzoek waaraan het Alzheimer Research Center (ARC) deelneemt. Omdat het onderzoek naar een geneesmiddel voor alzheimer zich steeds meer richt op het voorkómen van de ziekte, zoekt het onderzoekscentrum steeds vaker mensen die nog geen klachten hebben maar wel risico hebben op het ontwikkelen van de ziekte. “Deze mensen vinden we dus alleen via advertenties”, vertelt de directeur van het ARC Niels Prins. “Gelukkig komen daar veel mensen op af. Ongeveer een op de tien die zich aanmeldt is geschikt om mee te doen, omdat bij hen een alzheimer-verandering aantoonbaar is.” Tegen de deelnemers zegt Prins altijd: “Aan meedoen zitten drie voordelen en drie nadelen. Er bestaat een kans dat je een middel krijgt dat effectief is, je levert een bijdrage aan het vinden van een werkzaam geneesmiddel en je komt regelmatig op een plek waar veel ervaring is met alzheimer en je vragen kan stellen. Maar het is nooit ongevaarlijk, je hebt een kans dat je placebo krijgt en je moet ongeveer een keer per maand naar het centrum komen.” Radboudumc stopt In tegenstelling tot neuroloog Niels Prins van het Alzheimer Research Center in Amsterdam zijn onderzoekers in het Radboudumc in Nijmegen gestopt met onderzoek naar geneesmiddelen die zijn gericht tegen het alzheimereiwit amyloïd-bèta. In het Radboudumc geloven de wetenschappers er niet meer in dat het opruimen van dit eiwit de ziekte van Alzheimer kan genezen. Volgens Marcel Olde Rikkert, hoog-leraar geriatrie aan het Radboudumc en hoofd van het Radboudumc Alzheimer Centrum, is de ziekte van Alzheimer een verouderingsziekte die veel complexer is dan de schade die het amyloïd-bèta-eiwit veroorzaakt. Zorgverleners richten zich dan ook op het leren omgaan met de ziekte. Het ziekenhuis wil hun patiënten daarom geen valse hoop meer geven door geneesmiddelen gericht tegen dit eiwit te testen. Onderzoek naar amyloïd-bèta en de diagnostiek van alzheimer, loopt wel door. Literatuur 1. Stichting Alzheimer Nederland, www.alzheimernederland.nl/dementie, geraadpleegd op 13-01-2017 2. www.arconderzoek.nl/alzheimer/vormen-vandementie, geraadpleegd op 13-01-2017 3. Kennedy ME, Stamford AW, Chen X et al. The BACE1 inhibitor verubecestat (MK8931) reduces CNS β-amyloid in animal models and in Alzheimer’s disease patients. Sci Transl Med. 2016;8(363):363ra150. 4. Sevigny J, Chiao P, Bussière T et al. The antibody aducanumab reduces Aβ plaques in Alzheimer’s disease. Nature. 2016;537(7618):50-6. 5. www.alzforum.org/therapeutics/gantenerumab, geraadpleegd op 17-01-2017 6. Gauthier S, Feldman HH, Schneider LS et al. Efficacy and safety of tau-aggregation inhibitor therapy in patients with mild or moderate Alzheimer’s disease: a randomised, controlled, double-blind, parallelarm, phase 3 trial. Lancet 2016;388(10062):28732884. 7. www.alzforum.org/therapeutics/c2n-8e12, geraadpleegd op 17-01-2017 8. Novak P, Schmidt R, Kontsekova E et al. Safety and immunogenicity of the tau vaccine AADvac1 in patients with Alzheimer’s disease: a randomised, double-blind, placebo-controlled, phase 1 trial. Lancet Neurol. 2016 Dec 9 [Epub]. pii: S14744422(16)30331-3. 9. www.alzforum.org/therapeutics/neflamapomid, geraadpleegd op 17-01-17