Nova Scheikunde 4 vwo | gymnasium
Hoofdstuk 3
Diagnostische toets
uitwerkingen
Diagnostische toets
3
Zouten
Uitwerkingen
1
a
b
c
MgCl2
Al(OH)3
(NH4)2SO3
2
a
b
c
bariumcarbonaat
kaliumsulfide
ijzer(III)sulfaat
3
a
CuCl2 (s) Cu 2+ (aq) + 2 Cl- (aq)
b
Na 2 O(s) + H 2O(l) 2 Na + (aq) + 2 OH- (aq)
Cu 2+ (aq) + 2 OH- (aq) Cu(OH) 2 (s)
c
d
Koper(II)ionen geven de oplossing een blauwe kleur. Als de vloeibare fase van de
ontstane suspensie blauw is, weet je dus dat er koper(II)ionen in oplossing aanwezig zijn. De
koper(II)ionen waren in dat geval in overmaat aanwezig.
0,100 2,5 102 2,5 103 mol Cu 2+ .
0,150 3,0 102 4,5 103 mol OH - .
molverhouding Cu 2+ : OH - = 1:2; Cu 2+ is in overmaat.
4,5 103
e
Er kan maximaal
2, 25 103 mol Cu 2+ neerslaan.
2
2,5 103 2, 25 103 2,5 104 mol Cu 2+
2,5 104
[Cu 2 ]
1 103 M
0, 250
4
a
b
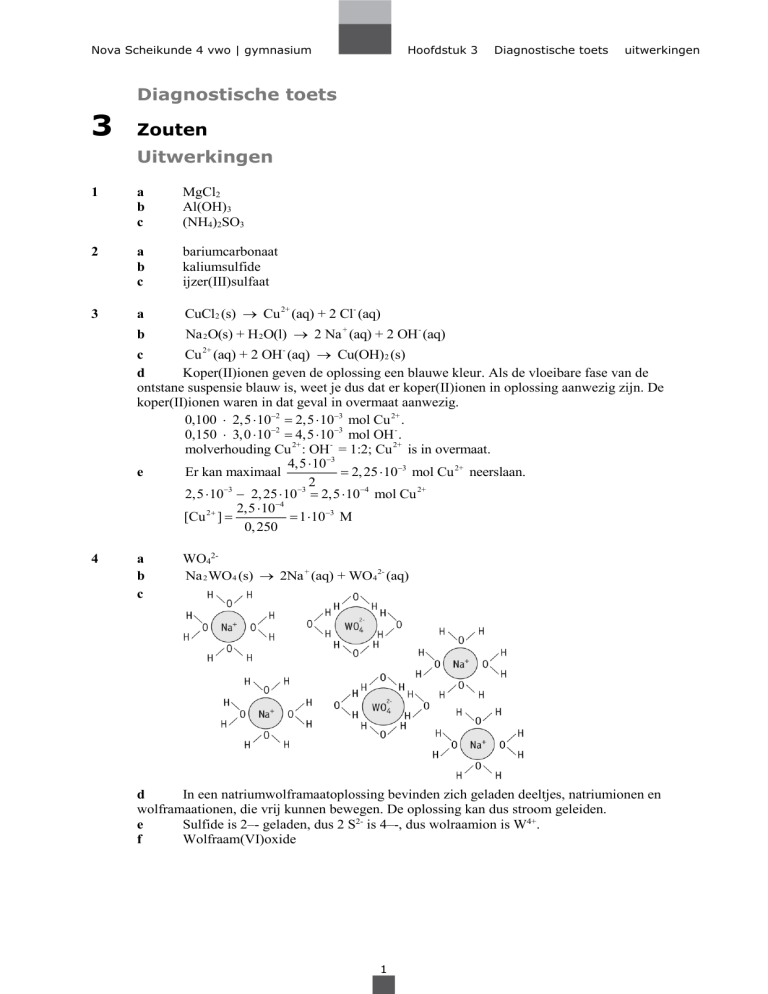
c
WO42Na 2 WO4 (s) 2Na + (aq) + WO4 2- (aq)
d
In een natriumwolframaatoplossing bevinden zich geladen deeltjes, natriumionen en
wolframaationen, die vrij kunnen bewegen. De oplossing kan dus stroom geleiden.
e
Sulfide is 2–- geladen, dus 2 S2- is 4–-, dus wolraamion is W4+.
f
Wolfraam(VI)oxide
1
Nova Scheikunde 4 vwo | gymnasium
5
a
b
c
6
Hoofdstuk 3
Diagnostische toets
uitwerkingen
MgSO4 + x H2O MgSO4 xH2O
105
100% 51, 2%
205
120, 4 105 126, 42 gram kristalwater per mol MgSO 4 .
126, 42
7, 0 mol water per mol MgSO 4 . x 7
18, 016
NaC17 H35COO(s) Na + (aq) + C17 H 25COO- (aq)
a
C17 H35COOH(s) C17 H25COOH(aq) . Er lost maar heel weinig stearinezuur op in water!
b
Een emulgator heeft een hydrofobe staart en een hydrofiele kop. Stearinezuur voldoet
aan deze omschrijving. De lange alkylstaart is hydrofoob en de carbonzuurgroep kan
waterstofbruggen vormen en is dus hydrofiel.
c
d
2
