Uitwerking Tentamen Organische Chemie A,
8S110
Donderdag 17 januari 2008
Opgave 1.
Lewis-elektronenstructuren
12 punten (9-3)
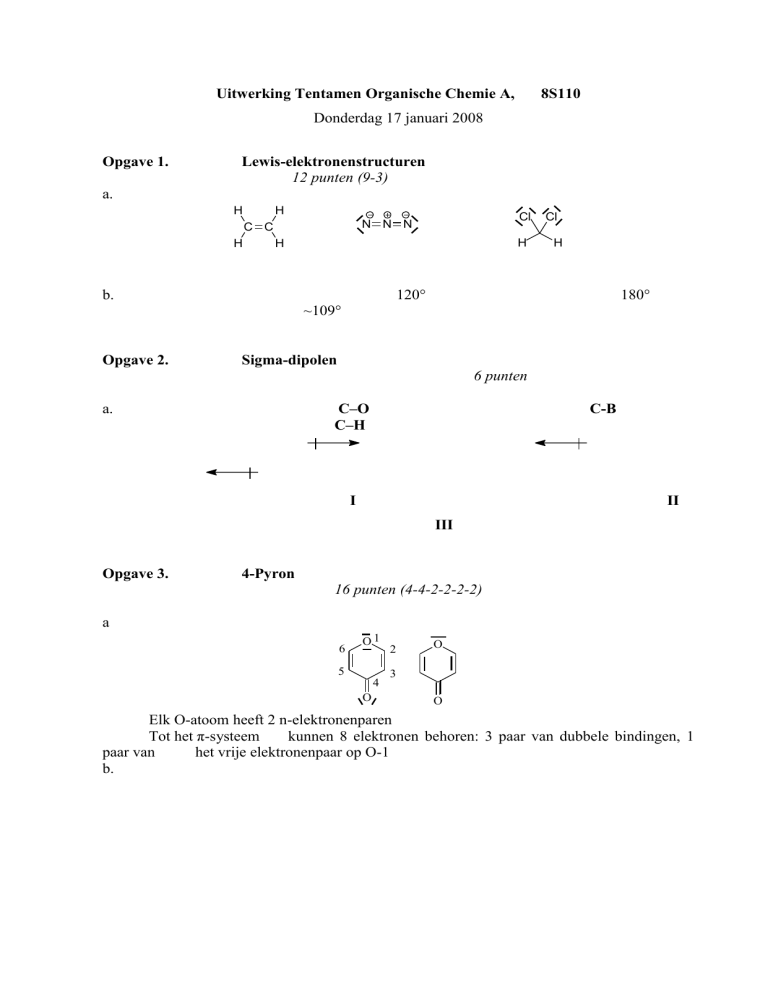
a.
H
H
H
Cl
N N N
C C
H
H
b.
Cl
H
120°
180°
~109°
Opgave 2.
Sigma-dipolen
6 punten
a.
C–O
C–H
C-B
I
II
III
Opgave 3.
4-Pyron
16 punten (4-4-2-2-2-2)
a
6
O1
5
4
O
2
O
3
O
Elk O-atoom heeft 2 n-elektronenparen
Tot het π-systeem
kunnen 8 elektronen behoren: 3 paar van dubbele bindingen, 1
paar van
het vrije elektronenpaar op O-1
b.
O
O
O
O
O
O
O
O
O
O
c.
d.
e.
Hz
3
C6D6):
f.
C-4 en C-2; zie onder b.
O carbonyl en C-3; zie onder b.
2 signalen: H-2 (H-6) bij laagste veld, grotere chemical shift (δ 6,6; 2 H, doublet, J = 6
in C6D6): C-H gebonden aan O (elektronegativiteit) en C-H geconjugeerd met C=O; H(H-5) bij
hoogste veld, kleinere chemical shift (δ 5,6; 2 H, doublet, J = 6 Hz in
conjugatie
met O- 1.
Ja, zie resonantiestructuren onder b. rechts onder en links en rechts boven.
Opgave 4.
Aromaticiteit
8 punten [3 goed 5; 2 goed 2]
N
II (14 π)
VI (6 π)
Opgave 5.
V
(2
π)
VII (6 π)
Conformatie en Configuratie
14 punten (5-3-3-3)
a. Conformeren I en II zijn niet in de stabielste confomatie getekend
H
F
H3C
H
CH3
H3C
F
H
H
Cl
H
CH3
H
H
H
H
CH3
H
H
I
II
staggered en anti
equatoriaal i.p.v. axiaal
b. Newman-projectie III
HO
HO
COOH
H
H
COOH
Me-
en
i-Pr-groepen
c.
H
O
H N
CH3
S R
H3C
N H
O
H
OH HO
H
OH
R
O
H
S H
H
R
HO H
O
CH3
H
R
CH3
IV
V
VI
d. Enkel verbinding V is chiraal; IV en VI zijn meso-verbindingen en dus achiraal
Opgave 6.
Aciditeit
13 punten (5-4-4)
a.
H
H
O
H
O
O
OH
H H
H3C
O
CH3
H3C
H
O
O
O
Cl O
Cl
H
CH3
H
Cl
H H
I
H
H
H H
II
IV
OH
H H
H
III
V
b.
H H
O
H
O
H H
H H
H 2C
O
H
O
CH3
H 2C
H 3C
O
O
O
O
H
O
CH3
H 3C
O
H
H
Cl
Cl O
Cl
H
CH3
H
H
H
O
O
H H
H
O
O
H
H
H
H 3C
Cl O
Cl
H
CH3
Cl
H
H
O
H
H
O
O
c.
CH3
H
O
O
H H
O
O
H
O
H H
H
H
H
H
H
H
Aciditeit: IV < II < III < I < V (pKa waarden respectievelijk ~ 36, 25, 13, 5 en 3)
Opgave 7.
Kinetiek en Thermodynamica
9 punten (3-3-3)
a.
SN1: 2-staps; 1 intermediair en 2 overgangstoestanden, waarvan de 1e hoger is in
energie
dan de tweede; het product is lager in energie dan de uitgangsstoffen
b.
De E2 eliminatie is een 1-staps proces met 1 overgangstoestand; het gevormde alkeen is
energetisch hoger dan het gesubstitueerde alkaan
c.
Keto-enol van aceton: H3C-CO-CH3 en H2C=C(OH)-CH3 : 1 intermediair
(enolaatanion) en 2 overgangstoestanden; energie keto lager dan die van enol;
energieverschil overgangs- toestand en intermediair naar keto groter dan energieverschil
overgangstoestand en intermediair naar enol; enol is het kinetische; keton is het
thermodynamische product
Opgave 8.
Reacties
22 punten (12-4-6)
a.
A
H3C
Br
H
+
H
Br-Br
H
CH3
H3C
H Br
CH3
B
C
H OSO2CH3
+
N3
NaN3
O
H
+
CH3SO3Na
O
+
[HO-]
H
OH
H2O
D
Br
+
HBr
+
HCl
H
Br
H
+
of
Br
E
0,5
OH
G
Br
OH
+
+
H2O
O
H3C
b.
A.
B.
C.
D.
E.
0,5
+
Cl
H2O
Cl
F
H
+
Additie
Substitutie
Eliminatie
Additie
Substitutie
SO2
+
K2CO3
+
O
KBr
+
KHCO3
[H+]
OH
CH3
H3C
CH3
+
K-O-t-Bu
CH3
+
HO-t-Bu
+
CH3SO3K
F.
G.
H.
c.
A.
B.
C.
D.
E.
F.
G.
H.
Substitutie (2x)
Additie
Eliminatie
Anti-additie, tweestaps, 2 chirale bromoniumkationen als intermediair; 2e stap SN2 met
inversie van configuratie, via 4 wegen tot 1 mesoverbinding
Substitutie SN2, éénstaps, inversie van configuratie, trigonaal bipyramidale
overgangstoestand, (R)-azide gevormd
E1cB-eliminatie, tweestaps, via planair enolaatanion
1,2-Additie, tweestaps, resonantiegestabiliseerd planair carbokation, ontstaan via
Markovnikov-additie (thermodynamisch stabieler dan 1,4-adduct wegens hoger aantal
alkylsubstituenten op de C=C)
SN1-substitutie, zuurgekatalyseerd, tweestaps, via planair carbokation, racemisatie
Dubbele substitutie; eerst zuur-base fenol naar fenolaatanion; daarna SN2 fenolaat op
benzylbromide
tweestaps Markovnikov additie via stabiel planair carbokation
E2-eliminatie, éénstaps, antiperiplanaire overgangstoestand, 1 enantiomeer: 1 trans-proton
aanwezig t.o.v. methaansulfonaat (vertrekkende groep)
____________________________________________________________________________
