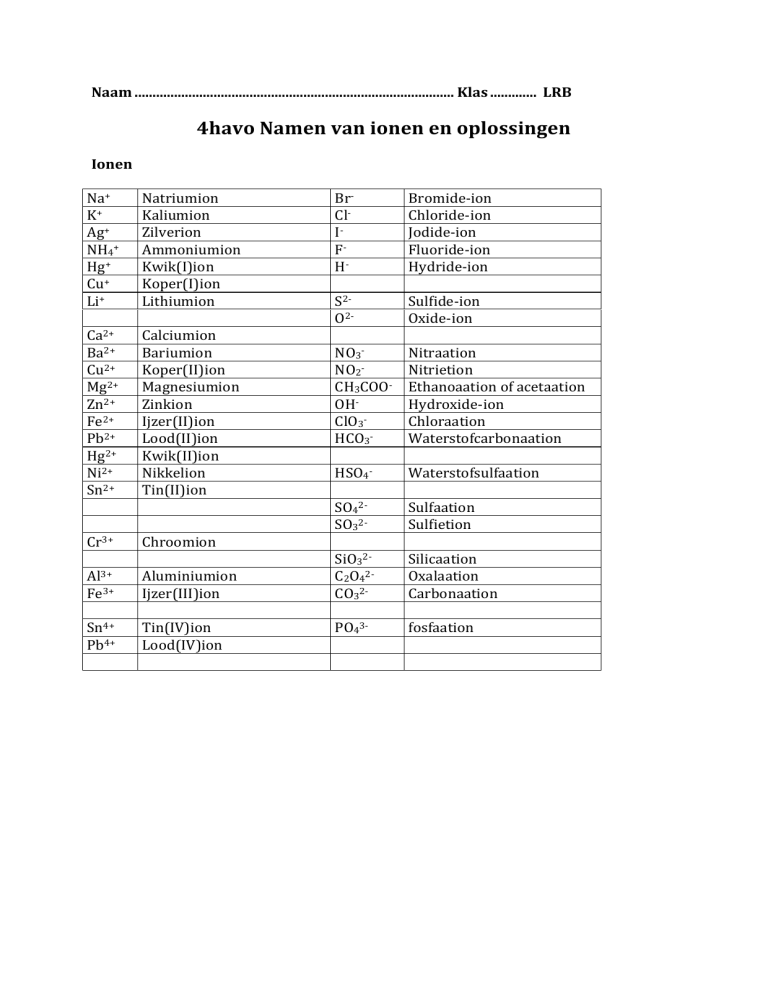
Naam ......................................................................................... Klas ............. LRB 4havo Namen van ionen en oplossingen Ionen Na+ K+ Ag+ NH4+ Hg+ Cu+ Li+ Ca2+ Ba2+ Cu2+ Mg2+ Zn2+ Fe2+ Pb2+ Hg2+ Ni2+ Sn2+ Cr3+ Al3+ Fe3+ Sn4+ Pb4+ Natriumion Kaliumion Zilverion Ammoniumion Kwik(I)ion Koper(I)ion Lithiumion Calciumion Bariumion Koper(II)ion Magnesiumion Zinkion Ijzer(II)ion Lood(II)ion Kwik(II)ion Nikkelion Tin(II)ion Chroomion Aluminiumion Ijzer(III)ion Tin(IV)ion Lood(IV)ion Br-­‐ Cl-­‐ I-­‐ F-­‐ H-­‐ S2-­‐ O2-­‐ NO3-­‐ NO2-­‐ CH3COO-­‐ OH-­‐ ClO3-­‐ HCO3-­‐ HSO4-­‐ SO42-­‐ SO32-­‐ SiO32-­‐ C2O42-­‐ CO32-­‐ PO43-­‐ Bromide-­‐ion Chloride-­‐ion Jodide-­‐ion Fluoride-­‐ion Hydride-­‐ion Sulfide-­‐ion Oxide-­‐ion Nitraation Nitrietion Ethanoaation of acetaation Hydroxide-­‐ion Chloraation Waterstofcarbonaation Waterstofsulfaation Sulfaation Sulfietion Silicaation Oxalaation Carbonaation fosfaation Oplossingen (zie ook Tabel 66A in Binas) Naam van de oplossing Naam van de opgeloste stof Natronloog Natriumhydroxide Kaliloog Kaliumhydroxide Kalkwater Calciumhydroxide Barietwater Bariumhydroxide Uit natrium-­‐, kalium-­‐, calcium-­‐ en bariumoxides ontstaan ook deze oplossingen Voorbeeld DTM-­‐T Vul onderstaande tabel verder in: Naam van het ion Formule Fe2+ Jodide-­‐ion Fosfaation S2-­‐ CH3COO-­‐ Vul onderstaande tabel verder in: Naam van het zout Formule FeCl3 Kaliumoxide Aluminiumsulfaat CuOH SnF4 Geef de vergelijking voor onderstaande reacties (gegeven is dat alle zouten die in deze opgave oplosbaar zijn in water): 1. Het oplossen van ammoniumsulfiet in water. 2. Het indampen van een oplossing van koper(II)nitraat. 3. Het oplossen van calciumoxide in water 4. Het indampen van een oplossing van kaliumoxide.
