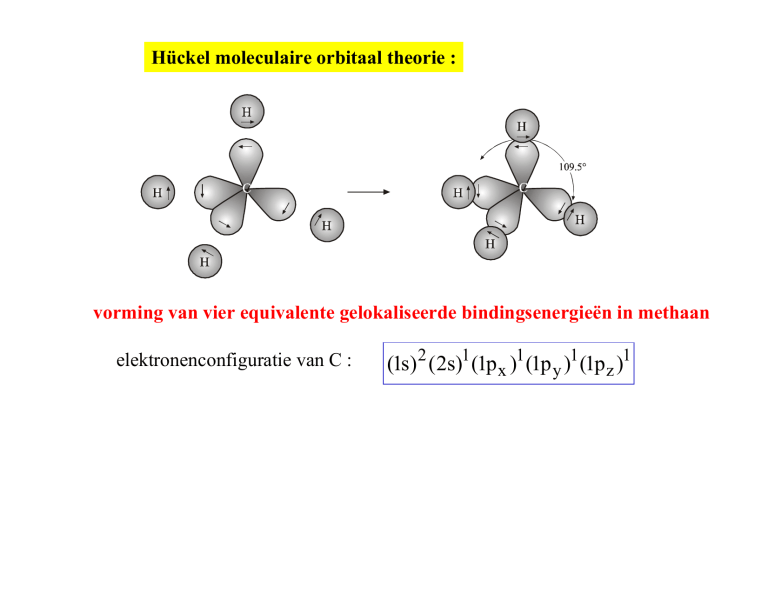
Hückel moleculaire orbitaal theorie :
vorming van vier equivalente gelokaliseerde bindingsenergieën in methaan
elektronenconfiguratie van C :
(1s) 2 (2s)1 (1p x )1 (1p y )1 (1p z )1
vorming van de C-C σ binding in ethaan
hoe groter de overlap der orbitalen :
des te stabieler de binding
vorming van de C-C σ binding in etheen
vorming van de C-C π binding in etheen
π-elektronen benadering
vorming van de C-C σ bindingen in
benzeen
c
c
twee Kékulé structuren
c
c
c
c
Ψ =
c
c
c
|ΨA>
c
c
c
|ΨB>
1
2
( ΨA
+ ΨB
)
resonantie energie
Hückel moleculaire orbitaal theorie :
π- elektronen bewegen in eenvlak evenwijdig met het vlak van de σ-bindingen
π- elektronen zijn gedelokaliseerd
ethyleen :
MO: Ψ π = c1 2p zA + c 2 2p zB
ˆ =H
ˆ +H
ˆ +H
ˆ +H
ˆ
H
σ
π
σπ
ππ
beschouw de beweging der π-elektronen apart :
seculaire
determinant :
H11 − ES11
H12 − ES12
H12 − ES12
=0
H 22 − ES22
ˆ 2p
H11 = 2p zA H
zA = α
S11 = 2p zA 2p zA = 1
ˆ 2p
H12 = 2p zA H
zB = β
S12 = 0
E = α±β
met β < 0
α-β
E
Ψ bond =
1
2
Ψ antibond =
( 2pzA
+ 2p zB
)
1
( 2pzA − 2pzB
2
)
E π = 2α + 2β
bindingsenergie bij gelokaliseerde π-binding
α+β
butadieen :
H
H
C
H
C
C
H
H
C
H
4
MO: Ψ πi = ∑ c ni 2p zn
n =1
seculaire
determinant :
0
0
α−E
β
0
β
α−E
β
=0
β
α−E
β
0
β
α−E
0
0
E = α ± 1.61804 β
E = α ± 0.61804 β
α - 1.618 β
E
α - 0.618 β
α + 0.618 β
α + 1.618 β
E π = 4α + 4.472β
delokalisatie energie =
E π (butadieen) − E π (ethyleen) = 0.472 β
= − 35kJ / mol bij β = −75kJ / mol
delokalisatie energie verantwoordelijkheid voor stabiliteit van de butadieen
molecule t.o.v. twee geïsoleerde dubbele bindingen
Ψ1 = 0.3717 2p z1 + 0.6015 2p z2 + 0.6015 2p z3 + 0.3117 2p z4
Ψ 2 = 0.6015 2p z1 + 0.3717 2p z2 − 0.3717 2p z3 − 0.6015 2p z4
Ψ 3 = 0.6015 2p z1 − 0.3717 2p z2 − 0.3717 2p z3 + 0.6015 2p z4
Ψ 4 = 0.3717 2p z1 − 0.6015 2p z2 + 0.6015 2p z3 − 0.3117 2p z4
fractionele π-elektronen
bijdrage vanwege een elektron
in MO i tot het nde atoom C
qn =
∑
i(bezet)
n i cni
2
π-bond order :
π
Pnm
= ∑ n i c ni c mi
i
H
π
π
P12
= 0.8942 = P34
π
P23
H
1
C
= 0.4473
C
2
H
C
H
3
4
H
C
H
C1
benzeen :
C6
C2
C5
C3
C4
E π = 6α + 8β
α - 2β
E
delokalisatie energie =
α-β
E π (benzeen) − E π (ethyleen) = 2 β
= − 70 kJ / mol bij β = −75kJ / mol
α+β
α + 2β
